- Способы измерения артериального давления у крыс
- Артериальное давление у крыс
- Артериальное давление у крыс
- Артериальное давление у крыс
- Занятие 26. Нарушения сосудистого тонуса гипертония и ее патогенез
- Цель занятия
- Подготовка к занятию
- Наименование опытов и методика их проведения
- Устройство плетизмометрического аппарата
- Камера для иммобилизации ненаркотизированных крыс
- Определение артериального давления у крыс
Способы измерения артериального давления у крыс
Для регистрации артериального давления у крыс и мышей используют кимографический метод с применением пневматического усилителя, разделенного металлической мембраной на 2 части, одна из которых заполнена жидкостью и соединена катетером с общей сонной артерий. Через вторую часть пневматического усилителя должен непрерывно подаваться воздух в количестве 2 л в минуту.
Для измерения артериального давления на наркотизированных и ненаркотизированных крысах в последние годы используют реографический метод, который позволяет определить колебания давления крови в артериях хвоста и конечностей (А.А. Гамалея, А.X. Коган, 1977). Кроме того, используют также водяные, пьезоэлектрические или резисторные датчики (Е.С. Стальненко и др., 1969; Я.Б. Максимович и др., 1971; А.X. Коган, 1973), с помощью которых фиксируют изменения объема хвоста животного Однако существенным недостатком указанных методов регистрации артериального давления у крыс является малая величина полезного сигнала по сравнению с сигналами, возникающими при движениях хвоста, вовремя дыхания или в период беспокойства животного. Ю.А. Зотов (1974) разработал фотоплетизмографический метод измерения артериального давления у ненаркотизированных крыс. Этот метод основан на регистрации кровенаполнения, в связи с чем помехи, возникающие при движении животного, невысоки по амплитуде и существенно отличаются по своей форме от характерных фотоплетизмографических осцилляций. Использование усилителя почти полностью исключает влияние перемещений животного на положение регистрируемой кривой.
Пульсовые осцилляции регистрируются стандартным пальцевым фотоплетизмографическим датчиком, в котором фотоэлемент и источник света находятся в одной плоскости. Датчик помещается диетальнее окклюзионной манжетки в трубке, ограничивающей движения хвоста. Крысу при этом помещают в иммобилизационную клетку.
Артериальное давление большинства крыс, регистрирующееся из сонной артерии, составляет 13,3—17,3 кПа (100—130 мм рт. ст.).
В хронических опытах давление крови у крыс довольно часто измеряют методом плетизмографии хвоста. Этот метод измерения показывает, что давление крови составляет чаще всего 11,5—17,1 кПа (86—128 мм рт. ст.).
Источник
Артериальное давление у крыс
Многочисленные научные обзоры отражают тот факт, что оксид азота (NO) играет ключевую роль в регуляции кардиоваскулярного гомеостаза: NO вовлекается в механизмы гемостаза, контролирует барорефлекс, оказывает стресс-лимитирующие эффекты, регулирует баланс вегетативных влияний на сердечно-сосудистую систему [5,9]. В наших предыдущих исследованиях было показано, что снижение генерации NO ассоциируется с повышением кардиоваскулярной стресс-реактивности и развитием артериальной гипертонии [1,3,6].
Таким образом, количественное описание сложности эволюционной динамики сигналов кровяного давления и сердца в условиях изменения активности NO-ергической системы при различных физиологических состояниях организма могут иметь важное прогностическое и диагностическое значение.
Цель работы
Изучение эффектов активности NO-синтазы на динамику кровяного давления у самок крыс на основе применения теории вейвлетов. Этот выбор обусловлен результатами предыдущих исследований [6], которые позволили сделать предварительные выводы о том, что критические изменения в деятельности ССС, наблюдаемые у самок в условиях блокады синтеза оксида азота, сочетаются у них с уменьшением сложности динамики в высокочастотной области спектра (ВЧ, 0,75-3,0 Гц) на фоне менее выраженных изменений динамики в низкочастотной области (НЧ, 0,25-0,75 Гц). Напротив, у самцов, сердечно-сосудистая система которых менее чувствительна к блокаде NO-ергического звена регуляции, не наблюдалось значительных изменений сложности ни в ВЧ-, ни НЧ-областях спектра.
Материалы и методы исследования
Эксперименты были выполнены на 24 белых половозрелых самках крыс. Животным были имплантированы внутрисосудистые катетеры под нембуталовым наркозом (45 мг/кг) для прямого измерения кровяного давления (КД). Запись сигналов кровяного давления осуществляли с помощью совместимого с компьютером многоканального измерительно-вычислительного комплекса PowerLab/400 ML401 и программного обеспечения Chart 4 (ADInstruments Ltd., Австралия). Блокаду активности NO-синтазы проводили путем введения NG-nitro-L-arginine-methyl-ester (L-NAME, 10 мг/кг, Sigma Chemical Co, iv). Все хирургические манипуляции проводили под общей нембуталовой анестезией (0,35 мг/кг, ip). Для статистической обработки экспериментальных данных использовали пакет программ Statistica 5.0. Исследование структуры записанных сигналов проводилось на основе вейвлет-анализа [2,4], который является в настоящее время одним из наиболее популярных подходов к изучению эволюционной динамики физиологических процессов. К числу его достоинств относится возможность изучать как стационарные, так и нестационарные (переходные) процессы в динамике систем различной природы, возможность идентифицировать мгновенные характеристики многочастотных колебательных процессов [7] и т.д. Данный метод традиционно называют «математическим микроскопом» [2], который позволяет детально изучить структуру сложных сигналов в широком диапазоне масштабов.
Математическая процедура непрерывного вейвлет-преобразования некоторого сигнала предполагает его разложение по системе базисных функций, которые формируются путем масштабных преобразований и переносов вдоль временной оси так называемого «материнского» вейвлета ψ:
где x(t) — анализируемый сигнал КД, W(a,b) — коэффициенты преобразования, a — масштаб наблюдения, b — параметр смещения вдоль оси времени. При проведении частотно-временного анализа экспериментальных данных традиционно используют вейвлет Морле:
Параметр f0 данной функции подбирается таким образом, чтобы достичь компромисса между разрешением сигнала x(t) по времени и по частоте [2]. Вместо коэффициентов W(a,b) на практике удобно оперировать с плотностью энергии E(a,b)=|W(a,b)| 2 , эволюция локальных максимумов которой соответствует мгновенным частотам ритмических процессов, а усреднение плотности энергии по времени является аналогом сглаженного спектра мощности. Примеры вейвлет-анализа сигналов КД можно найти в работе [6]. В результате проведения данного анализа идентифицируются временные зависимости мгновенных частот f1(t) и f2(t), характеризующих динамику ритмических процессов в НЧ- и ВЧ-областях спектра соответственно.
Для количественного описания сложности динамики КД будем использовать одну из стандартных характеристик — энтропию Шеннона:
где N — число разбиений диапазона изменения мгновенной частоты, Pk — вероятность того, что значение мгновенной частоты попадает в k-й интервал разбиения ширины Δ. По аналогии с работой [6] для анализируемого ритма f1(t) и f2(t) всех экспериментальных данных целесообразно использовать одинаковую меру неопределенности Δ.
Таким образом, в рамках проводимого исследования мы акцентируем внимание на отслеживании временной эволюции различных ритмических составляющих (мгновенных частот, соответствующих тому или иному ритму) и количественном описании сложности эволюционной динамики применительно к каждому ритму в отдельности. В общем случае для постоянного значения частоты (стабильный ритм) Hp=0 при совершенно случайном поведении мгновенной частоты ритма Hp принимает максимальное значение, равное log N.
Результаты исследования показали, что блокада синтеза NO сопровождалась уменьшением значений энтропии Hp, что свидетельствует об эффекте стабилизации частоты ритмических процессов, которые диагностируются как в низкочастотной, так и в высокочастотной областях спектра. В частности, они четко диагностировались в высокочастотной области, изменения количественной меры сложности в которой в отдельных экспериментах достигает 10-15% при блокаде синтеза NO по сравнению с базовым уровнем. В низкочастотной области также можно обнаружить изменения сложности экспериментальных данных, связанные с введением L-NAME, но они обычно менее выраженные (не более 10%). Однако как в НЧ-, так и в ВЧ-областях эффекты стабилизации ритмической динамики являются значительными в соответствии с критерием Манна-Уитни (p
Источник
Артериальное давление у крыс
Артериальная гипертензия (АГ) является одним из основных факторов, вызывающих развитие хронической сердечной недостаточности (ХСН) и инфаркта миокарда [4]. Хроническое воздействие повышенного артериального давления (АД) со временем приводит к ослаблению инотропной функции сердца и застойным явлениям в разных отделах организма.
Традиционно ХСН связывают с нарушением систолической функции миокарда. Однако по современным представлениям на патофизиологию ХСН систолическая дисфункция рассматривается только как один из факторов наряду с изменением напряжения стенок и структуры диастолического наполнения, т.е. со всем тем, что включается в понятие «ремоделирование миокарда» [9, 10]. В последние годы все чаще встречаются данные о большой значимости диастолической дисфункции (ДД) в возникновении, клиническом течении и прогнозе ХСН [10].
Исследования нарушения сердечной деятельности у животных с различными моделями АГ сфокусировано, главным образом, на выраженном снижении инотропной функции миокарда, наблюдаемом на поздних этапах развития ХСН. Однако для понимания патогенеза ХСН и поиска новых терапевтических подходов не меньшее значение имеет изучение ранних маркеров поражения сердца, в том числе, и ДД. У крыс со спонтанной гипертензией (spontaneously hypertensive rat, SHR), общепринятой модели первичной АГ, выраженная манифестация ХСН наблюдается после 18 месяцев жизни, что отражается в значительном снижении сократительной способности сердца [2]. Вместе с тем, разными исследователями было показано, что у крыс данной линии уже в возрасте 4–6 мес выявляются признаки ДД, что выражается в росте конечного диастолического давления (КДД) и других показателей расслабления миокарда [5, 6]. Однако остается неясным как изменяется инотропная функция сердца в переходный период от «пограничной» к «стабильной» фазе гипертензии.
В связи с этим, целью данной работы было исследовать показатели сердечной деятельности и гемодинамики у крыс линии SHR разного возраста: в период формирования АГ (7–8 нед) и в период стабильно высокого АД (16–17 нед).
Материалы и методы исследования
Эксперименты проведены на 20 нормотензивных крысах линии Wistar-Kyoto (WKY) и 20 крысах линии SHR, полученных из вивария ИБХ РАН (Пущино, Россия). В виварии НИИФиРМ им. Е.Д. Гольдберга животные содержались в неполной барьерной системе при следующих параметрах окружающей среды: температура – 20–24 °С, относительная влажность воздуха – 50 ± 20 %, воздухообмен 12–15 объемов помещения в час, световой режим – 12:12 ч. Содержание животных осуществлялось в соответствии с правилами, изложенными в Европейской конвенцией по защите позвоночных животных (Страсбург, 1986). Протокол исследования утвержден комиссией по контролю за содержанием и использованием лабораторных животных НИИФиРМ им. Е.Д. Гольдберга (протокол №72052014).
АД и частоту сердечных сокращений (ЧСС) у крыс регистрировали с помощью системы неинвазивного измерения давления у ненаркотизированных (бодрствующих) мелких лабораторных животных NIBP200A («Biopac Systems, Inc.», США). Запись и обработка данных производилась на компьютере с помощью программы «AcqKnowledge 4.2 for MP150».
Измерения параметров работы сердца проводили под общим наркозом (тиопентал натрий, 80 мг/кг) на аппаратном комплексе для электрофизиологических исследований MP150 («Biopac Systems, Inc», США). В конце эксперимента животные подвергались эвтаназии передозировкой наркоза. Показатели сократительной функции сердца определяли по динамике внутрисердечного давления с помощью прибора для измерения внутрисердечного давления («OpSens», Канада). Доступ к левому желудочку сердца (ЛЖ) осуществлялся через правую общую сонную артерию с помощью датчика TSD282. Регистрировали следующие параметры: систолическое давление в левом желудочке (СДЛЖ, мм рт.ст), давление, развиваемое ЛЖ (мм рт.ст.), конечное диастолическое давление (КДД, мм рт.ст.), минимальное давление в левом желудочке (мм рт.ст.), индекс напряжение–время (мм рт. ст.), индекс сократимости ЛЖ (с-1), максимальную скорость нарастания (+dP/dt) (мм рт.ст./c) и снижения (-dP/dt) давления в ЛЖ (мм рт.ст./c).
Статистическую обработку полученных результатов проводили с использованием пакета статистических программ «Statistica 6.0». Данные представлены в виде M ± m, где M – среднее значение, m – стандартная ошибка среднего значения. Для оценки достоверности межгрупповых различий использовали непараметрический критерий Манна-Уитни.
Результаты исследования и их обсуждение
Для крыс линии SHR характерно раннее развитие АГ. У гипертензивных крыс период между 6-й и 8-й неделями жизни характеризуется начальным возрастанием АД [1]. В данном исследовании у крыс SHR возрастом 7–8 недель средние значения систолического АД (САД) и диастолического АД (ДАД) превышали значения аналогичных показателей у крыс WKY на 19 % и 22 % соответственно (табл. 1).
К концу 4-го месяца жизни у крыс SHR формируется выраженная АГ [4]. У крыс SHR в возрасте 16–17 недель САД и ДАД было выше, чем у крыс WKY, на 50 % и 48 % соответственно (табл. 1). ЧСС и масса тела животных в возрасте 7–8 недель не различались. В возрасте 16–17 недель масса тела крыс линии SHR был достоверно меньше на 9 % по сравнению со значением у крыс WKY (табл. 1).
Масса тела и гемодинамические показатели у крыс линии SHR в период возрастания (7–8 недель) и период стабильно высокого АД (16–17 недель) и у крыс линии WKY того же возраста
Источник
Артериальное давление у крыс
Занятие 26. Нарушения сосудистого тонуса гипертония и ее патогенез
Цель занятия
Ознакомиться с некоторыми экспериментальными моделями гипертонии и выяснить их значение для понимания патогенеза гипертонической болезни.
Подготовка к занятию
Студенты готовятся к данному занятию в объеме следующих вопросов.
1. Характеристика нарушений сосудистого тонуса. Гипертония, ее патогенез.
2. Основные экспериментальные модели гипертонии и методы ее воспроизведения.
* ( Пункты 1-7, 9-13 рассчитаны на группу студентов в 10-12 человек; 8, 14-22 — на рабочее место. Хирургический инструмент и материал предварительно стерилизуют и на занятиях укладывают на стерильное полотенце.)
Наименование опытов и методика их проведения
Опыт 1. Экспериментальные модели гипертонии у животных (демонстрация).
А. Невротическая гипертония у собаки. Демонстрируют собаку с гипертонией, вызванной путем срыва высшей нервной деятельности. Измеряют артериальное давление у нее и для сравнения у интактной собаки.
В норме артериальное давление у собаки колеблется в пределах 100-150 мм рт. ст.; при экспериментальной невротической гипертонии артериальное давление повышается до 140-200 мм рт. ст. и выше.
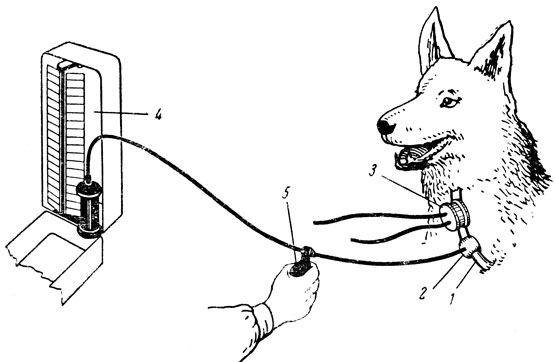
Для измерения артериального давления бескровным путем у собаки за 2-4 недели до опыта общую сонную артерию выводят в кожный лоскут. После заживления кожного лоскута измеряют артериальное давление. Для этого на пульсирующий кожный лоскут накладывают компрессионную резиновую манжетку, которую соединяют с ртутным манометром и нагнетательным баллоном (рис. 33). Для выслушивания артериальных тонов над манжеткой (выше ее) к пульсирующему кожному лоскуту прикладывают фонендоскоп. В манжетку нагнетают воздух до исчезновения артериальных тонов. Затем воздух постепенно выпускают из компрессионной манжетки; при этом отмечают момент появления артериальных тонов и момент смены звонких тонов глухими. Возникновение артериальных тонов является признаком систоличекого давления; смена звонких тонов глухими — признаком диастолического давления (артериальные тоны у собаки в отличие от человека, как правило, полностью не исчезают). Давление регистрируется в миллиметрах ртутного столба по показаниям манометра, соединенного с манжеткой.
Рис. 33. Измерение кровяного давления у собаки по Короткову в сонной артерии, выведенной в кожный лоскут по ван Леерсуму. 1 — сонная артерия, выведенная в кожный лоскут; 2 — компрессионная манжетка; 3 — фонендоскоп; 4 — ртутный манометр; 5 — нагнетательный баллон
Б. Рефлексогенная гипертония у собаки («гипертония растормаживания»). Для получения рефлексогенной гипертонии одномоментно или двухмоментно (с интервалом в 2 недели) перерезают депрессорные аортальные нервы и денервируют каротидный синус (можно иссечением). Уровень артериального давления после этих операций повышается на 40-100 мм рт. ст. Артериальное давление измеряют бескровным путем по описанной выше методике.
В. Острая рефлексогенная гипертония у кролика. Кролика фиксируют к столику на спине. Наркотизируют эфиром. Производят срединный продольный разрез кожи на шее. Находят трахею (ее покрывают мышцы — грудино-подъязычная и грудино-шитовидная). Обнажают обе боковые поверхности трахеи и находят симметрично расположенные шейные сосудисто-нервные пучки. Каждый состоит из: 1) сонной артерии, 2) блуждающего нерва (расположен по наружному краю сонной артерии), 3) симпатического нерва и 4) депрессорного нерва.
Депрессорный нерв в виде тонкой нити отходит (на уровне гортани) от угла, образуемого стволом блуждающего нерва и отходящим от него передним («верхним») гортанным нервом. Оба депрессорные нерва берут на лигатуры. Находят каротидные синусы — начальные (бульбовидно расширенные) отделы внутренних сонных артерий. Берут их на провизорные лигатуры.
В одну из общих сонных артерий вводят стеклянную артериальную канюлю; через систему трубок, заполненных антикоагулирующим раствором цитрата натрия или раствором гепарина, соединяют стеклянную канюлю с ртутным манометром, заполнив ее предварительно антикоагулирующим раствором. На ленте кимографа записывают исходное артериальное давление. Производят перерезку одного и затем второго депрессорного нерва. При этом наблюдают динамику артериального давления.
На каротидный синус интактной сонной артерии накладывают ватку, смоченную 1% раствором дикаина (или 3% раствором новокаина). Снова регистрируют артериальное давление и отмечают его изменение.
Г. Почечная гипертония у собаки. Почечная гипертония воспроизводится путем ишемизации почек. Существуют 2 основных способа ишемизации почек: 1) сужение почечной артерии при помощи зажима Гольдблатта, спирали (описание см. ниже) или шелковой лигатуры; 2) сдавление почек целлофаном или резиновой капсулой, натянутой на почки.
Артериальное давление при почечной гипертонии повышается на 40-100 мм рт. ст. и более. Почечная гипертония в отличие от невротической и рефлексогенной гипертонии характеризуется большой стойкостью.
Д. Почечная гипертония у крысы. Артериальное давление у крысы в норме равно 70-110 мм рт. ст. (реже 140 мм рт. ст.), при гипертонии оно повышается до 140-260 мм рт. ст.
Измеряется давление у крыс в хвостовой артерии бескровным путем, плетизмометрическим аппаратом.
Принцип платизмометрического метода измерения артериального давления у крыс. Компрессионной манжеткой, аналогичной той, которая имеется в аппарате Рива-Роччи, но повторяющей форму хвоста, сжимают хвостовые сосуды до полной остановки кровотока. Выпуская воздух из манжетки, постепенно уменьшают в ней давление. Когда оно становится равным систолическому, кровь по раскрывающейся артерии начинает притекать в периферическую часть хвоста, расположенную в плетизмометре. Так как оттока крови по еще сжатым венам нет, то периферическая часть хвоста набухает и увеличивается в объеме, что и регистрируется плетизмометром в виде подъема столба воды в его капилляре. Начало подъема и является признаком артериального систолического давления, которое отмечается по показаниям ртутного манометра, соединенного с компрессионной манжеткой.
Устройство плетизмометрического аппарата
( Описанный аппарат для бескровного измерения давления у крыс, камера для иммобилизации ненаркотизированных крыс и методики получения почечной гипертонии у крыс разработаны и созданы на кафедре патофизиологии I МОЛМИ А. X. Коганом.)
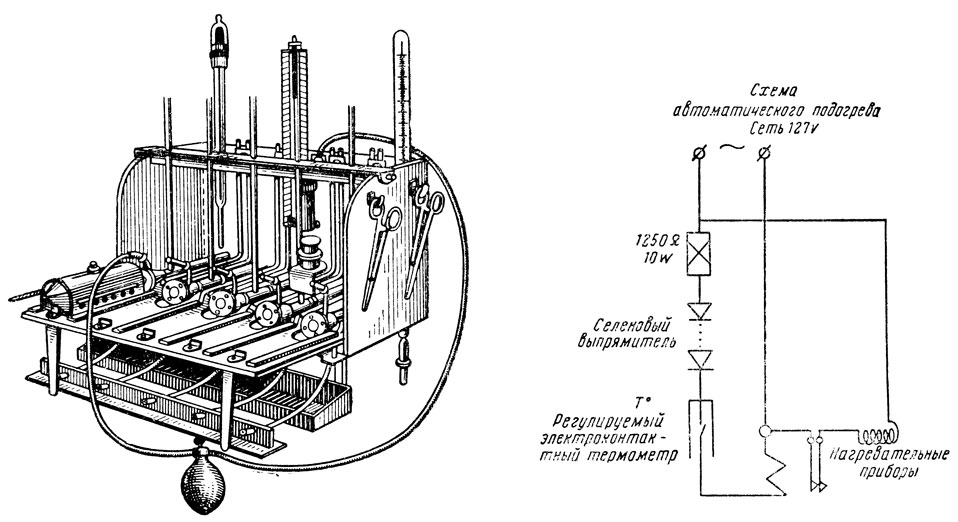
Аппарат (рис. 34) состоит из нескольких плетизмометрических измерительных приборов (2 и более, обычно 5), вмонтированных в ванночку, имеющую автоматически регулируемый электронагрев для поддержания постоянной температуры воды.
Рис. 34. Плетизмометрический аппарат (с автоматическим локальным подогревом) для конвейерного измерения кровяного давления в хвостовой артерии у ненаркотизированных крыс бескровным путем
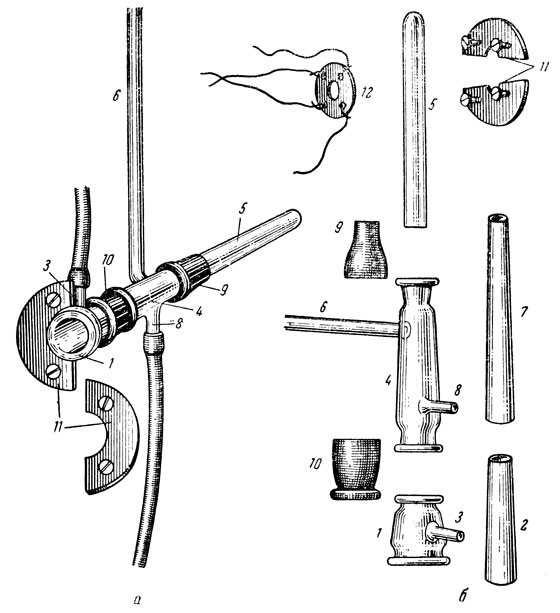
Каждый измерительный прибор (рис. 35, а и б) состоит из компрессионной манжетки, соединяющейся в момент определения давления с нагнетательным баллоном и ртутным манометром, и плетизмометра.
Рис. 35. Измерительный прибор плетизмометрического аппарата в собранном (а) и разобранном (б) виде (описание в тексте)
Компрессионная манжетка представляет собой стеклянную конусообразную трубку (1), через которую протянута резиновая трубочка (2), сделанная из хирургической перчатки, фиксированная ниткой на развернутых краях стеклянной трубки; имеет боковую трубку (3) для соединения с нагнетательным баллоном и манометром. Для предупреждения перерастяжения и выбухания резиновой трубочки через заднее отверстие компрессионной манжетки (что дает ложные подъемы столба воды в капилляре плетизмометра) на последнюю накладывают соответственных размеров фиксирующее кольцо (12) из резины (детские соски) или из плексигласа. Кольцо фиксируют нитками вокруг краев стеклянной трубки. Размеры стеклянной трубки компрессионной манжетки: длина 10-25 мм, диаметр входного отверстия 13 мм, диаметр выходного отверстия 11,5 мм, внутренний диаметр цилиндра 18 мм, длина боковой трубки (3) 30-40 мм, диаметр ее 2-3 мм.
Резиновая трубочка повторяет форму и размеры стеклянной трубки. Для унификации показаний, получаемых компрессионными манжетками, предложена проба на чувствительность. Под чувствительностью манжетки понимают минимальное давление в миллиметрах ртутного столба, необходимое для полного смыкания внутренних краев резиновой трубочки. Оно обычно не должно превышать 2-4 мм рт. ст.
Плетизмометр в отличие от других ранее описанных состоит из рабочей части (4) и концевой трубки (5). Рабочая часть представляет собой конусообразную стеклянную трубку (4), повторяющую форму хвоста, с капилляром (6), через которую протянута резиновая трубочка (7), сделанная из тонкой хирургической перчатки или презервативной резины. Края резиновой трубочки фиксированы ниткой на развернутых краях стеклянной трубки, благодаря чему между стеклянной и резиновой трубочкой образуется закрытая полость плетизмометра (сообщающаяся с капилляром), заполняющаяся во время опыта теплой водой, взятой из ванночки шприцем. Капилляр плетизмометра (6) впаян около выходного отверстия на 10-15 мм от его края и направлен вертикально вверх. В плетизмометре имеется также трубка (8), направленная вниз, которая служит для заполнения его водой и стока ее. Трубка (8) впаяна около входного отверстия на 10-15 мм от края его. Для предупреждения попадания воды в плетизмометры из ванночки, где они установлены, их задние отделы с помощью резиновых трубочек (9) (отрезков обычных сосок) соединяются с концевыми трубками (5), последними могут служить видалевские пробирки. Приводим размеры одного из наиболее часто применяющихся плетизмометров. Длина стеклянной конусообразной трубки (4) 80 мм, диаметр входного отверстия 11 мм, диаметр выходного отверстия 8 мм, внутренний наибольший диаметр 14 мм, диаметр капилляра 0,5-1 мм, длина отростка (8) 15-20 мм, диаметр его 2-3 мм.
Размеры резиновой трубочки (7) соответствуют размерам стеклянной трубки.
Ванночка служит для создания стабильного температурного режима в измерительных плетизмометрических приборах; она представляет собой четырехугольную коробку на 4 ножках с усеченной передней стенкой для удобства наблюдения плетизмометров, манометра, электроконтактного и ртутного термометра. Задняя пара ножек винтовые, с максимальной высотой 120 мм рт. ст., что позволяет производить некоторый подъем задней части аппарата, необходимый при заполнении плетизмометров водой для изгнания воздуха из них. Этой же цели может служить передвижная планка, через отверстия которой проходят верхние отрезки капилляров. Планка эта плотно прижимается к верхним краям боковой стенки с помощью винтов. Высота передних ножек 90 мм. Размеры ванночки могут варьировать в зависимости от количества измерительных приборов. При наличии 5 приборов размеры ее таковы: длина 450 мм, ширина 235 мм. Высота 240 мм. Ванночка снабжена 4 нагревательными спиралями, протянутыми через стеклянные трубки, засыпанные песком; расположены они между плетизмометрами, параллельно с ними для более равномерного их обогрева. Нагрев спиралей осуществляется сетевым током (127 V). Для автоматической регуляции температуры воды в ванночке в цепь нагревательных спиралей включается электроконтактный термометр через реле. Для контроля температуры воды имеется также ртутный термометр.
В передней стенке вверху имеются отверстия (диаметр 7 мм) для прохождения коротких резиновых соединительных трубок от компрессионных манжеток к нагнетательному баллону. Кроме того, в передней стенке имеются также специальные отверстия (диаметр 15 мм) для введения хвостов в плетизмометрические приборы (расстояние нижнего края отверстия от дна 20 мм). В дне ванночки имеются специальные отверстия, куда вставляются (туго) нижние отростки плетизмометров с надетыми на них резиновыми трубочками, через которые производят заполнение водой плетизмометров. Свободные концы этих трубочек вставляются в отверстия стойки, прикрепленной к ножкам столика. В центре дна ванночки имеется отверстие с металлической трубкой (диаметр 15 мм) для стока воды из нее.
Столик, куда во время опыта ставят камеры с крысами, представляет съемную площадку (450×220 мм), которая присоединяется к ванночке с помощью штифтов, спереди стоит на 2 ножках высотой 110 мм. На столике имеются плоские планки на 5 крысиных камер (высотой 3-5 мм, шириной 25-30 мм), между которыми устанавливают крысиные камеры. У переднего края столика между каждой парой планок имеется подвижный ограничитель для фиксации камер с крысами. В столике сделаны полуовальные вырезки, через которые во время опыта кал и моча падают в калоприемник, представляющий собой четырехугольное корытце из плексигласа длиной 450 мм, шириной 60 мм, высотой 15 мм.
Камера для иммобилизации ненаркотизированных крыс
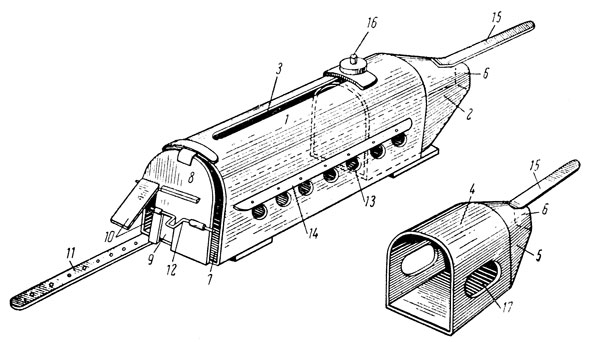
Камера (рис. 36) представляет собой полуовальный цилиндр (корпус) (1) с передвигающимся внутри наголовником (2). Последний имеет форму крысиной головы и позволяет приспосабливать объем камеры к размерам крысы, что обеспечивает иммобилизацию крысы, не прибегая к наркотизации или привязыванию ее. Размеры полуовального цилиндра: длина 17,5 см, высота 5,5-6,5 см, ширина 5-6 см. В верхней стенке цилиндра сделана прорезь (3) шириной 0,6-0,8 см, длиной 13 см. Наголовник состоит из арки (4) и корпуса (5). Арка повторяет форму и размеры корпуса камеры, прилегает внутри свободно к его стенкам, что позволяет ей легко передвигаться. Для фиксации наголовника в каком-либо нужном положении имеется прикрепленный к нему специальный винт (16), выступающий в прорезь цилиндра камеры, с насаженной сверху гайкой, позволяющий прижимать его к верхней стенке цилиндра. Длина арки 3,5-4 см, длина ребра конуса 3,5-4,5 см. В вершине конуса имеется отверстие (6) диаметром 1,5 см. К конусу прикреплена планка (15) длиной 10 см, шириной 1,3 см, с помощью которой он передвигается. Входное отверстие (7), через которое крысу помещают в камеру, имеет соответствующую ей по размерам дверцу (8). В последней сделаны: а) центральная вырезка в виде буквы «П» для прохождения крысиного хвоста (высота вырезки 2,5 см, ширина 1,4 см); б) одна или две боковые вырезки с дверцами (10) для вытаскивания лапок при определении хронаксии (высота вырезки 4,5-5 см, ширина 2-2,2 см). При хронаксиметрии вытянутую лапку привязывают к специальной планке (11) с отверстиями (прикрепленной винтом ко дну камеры, напротив вырезки). Планка может вращаться на винте, благодаря чему вне опытов с хронаксиметрией она задвигается под дно. Длина планки (11) равна 13,5 см, ширина 1,5-1,7 см. В корпусе (1) камеры имеется ряд отверстий (6, 7), каждое диаметром 1,5 см (13) для вытаскивания с помощью пинцета кожи и прокалывания ее игольчатыми электродами при съемке электрокардиограммы. Соответственно отверстиям (3) имеется вырезка (17) в арке наголовника (длина 3 см, ширина 1,5 см). Для более прочной фиксации игольчатых электродов над указанными выше отверстиями тянется планка (14), прикрепленная к боковой стенке камеры, с отверстиями, в которые вставляют иглы, прежде чем проколоть кожу.
Рис. 36. Схема универсальной камеры для иммобилизации ненаркотизированных крыс, для измерения кровяного давления, хронаксиметрии задних конечностей, электрокардиографии, электротермометрии и т. д. (описание в тексте)
Описанные приспособления для хронаксиметрии и записи электрокардиограммы могут быть использованы также для электротермометрии — подкожной и накожной. Пользуясь камерой, можно также производить ректальную термометрию, подкожные и внутримышечные инъекции; инъекции в хвостовые вены, взятие крови из хвостовых вен и т. д.
Определение артериального давления у крыс
Включением электронагрева поднимают температуру воды в ванночке до 37-40°. 3-5 крыс помещают в крысиные камеры. Новых крыс целесообразно предварительно приучить спокойно сидеть в камерах. С интервалом в 10 минут помещают хвосты крыс до корневой части, покрытой шерстью (можно с помощью длинного анатомического пинцета) в плетизмометрические измерительные приборы и устанавливают камеры с крысами на столике аппарата; камеры фиксируются передвижными ограничителями. Заполняют плетизмометры с помощью шприца водой 37-40°, извлеченной из ванночки, и накладывают зажимы на резиновые трубки (14) ко дну ванночки. Через 30 минут измеряют артериальное давление у первой крысы. Делают у нее 3-4 измерения в течение 4-8 минут, записывают в протокол пределы колебаний и среднюю величину давления и освобождают крысу. В освободившийся первый измерительный прибор помещают хвост нового животного. После этого приступают к измерению давления у второй крысы и через стандартное время (10 минут) у каждой последующей.
Источники ошибок: 1) ложные подъемы столбика воды в капилляре плетизмометра, обусловленные движением крысы; 2) болевые раздражения при неправильной посадке крысы в камеру; 3) неправильное введение крысиного хвоста в измерительный прибор (образование изгибов, неполное введение); 4) измерение давления у некоторых крыс без предварительного приучивания к сидению в камере; 5) воздушные карманы в плетизмометре.
Давление определяется у интактной крысы и у крысы с почечной гипертонией.
Опыт 2. Воспроизведение почечной гипертонии у крысы. Для получения почечной гипертонии у крыс производят ишемизацию почек путем сдавления их целлофановыми или резиновыми капсулами или сужения почечных артерий наложением спиралей.
Операция наложения целлофановой или резиновой капсулы на почку или спиралей на почечные артерии производится с соблюдением правил асептики: целлофан и спирали предварительно стерилизуют в 76° спирте в течение 3-4 суток. Хирургические материалы и инструменты стерилизуются обычным путем, руки хирурга после мытья щеткой обрабатываются спиртом, йодом.
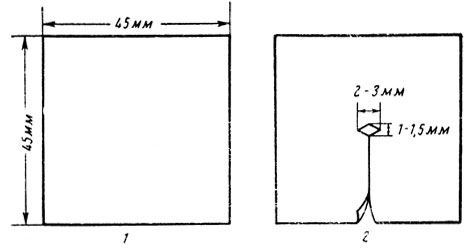
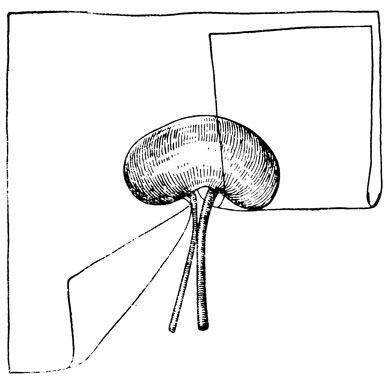
Ход операции. Крысу фиксируют к столику животом книзу. Шерсть на спине в области нижних грудных и поясничных позвонков выстригают. Кожу обрабатывают йодом. Животному дают эфирный наркоз. Операционное поле покрывают марлевой салфеткой с разрезом в центре. Разрез кожи длиной 2-3 см производится параллельно позвоночнику на 0,5 см латеральнее его; верхний край разреза начинается с правой стороны от реберной дуги, а с левой стороны — на 1 см ниже реберной дуги, так как левая почка расположена ниже правой (перед операцией для ориентации места разреза можно пальпаторно определить расположение почки). Послойно вскрывается кожа, апоневроз. Апоневроз образует фигуру, напоминающую римскую пятерку, вершина которой располагается на позвоночном столбе. Разрезают правую сторону «апоневротической пятерки». Край апоневроза оттягивается кнаружи. В разрезе становится видной околопочечная жировая клетчатка. Пинцетами, тупым путем, расширяют щель между жировой клетчаткой и околопозвоночными мышцами. Захватив жировую капсулу почки, последнюю осторожно вытягивают. Почку освобождают от окружающей ее клетчатки и окутывают целлофановой пластинкой размером 45×45 мм (рис. 37, 38). В центре листка целлофана прорезают отверстие для почечной ножки; разрезают с одной стороны листок — от края до центра. Через этот разрез целлофан надевается на почку, и края его прошивают вокруг почки матрацными швами с помощью прямой иглы. Накладывая швы на различном расстоянии от края почки, можно дозировать степень сдавления (ишемизации) почки. Целлофан должен плотно прилегать к почке, сдавливая ее. Затем почку погружают в рану, которую послойно зашивают. Через 2 недели на вторую почку также накладывают компрессионную целлофановую капсулу или же ее удаляют.
Рис. 37. Приготовление компрессионной пластинки. 1 — пластинка в развернутом виде; 2 — пластинка с образованным в центре нее ромбовидным отверстием для почечной ножки
Рис. 38. Наложение компрессионной пластинки (в виде капсулы) на почку
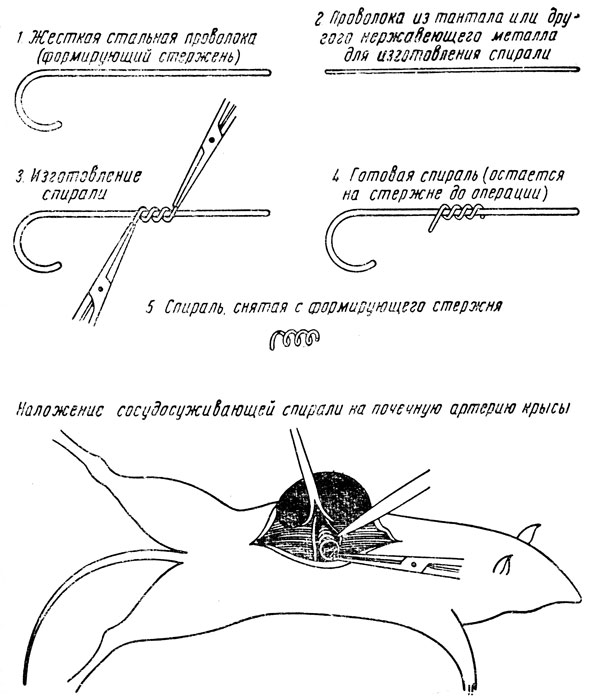
При операции сужения почечных артерий спиралью доступ к почкам аналогичен описанному выше. Почки при этом, однако, не освобождаются от жировой капсулы. Оттягивая почку с помощью специального ранорасширителя, отпрепаровывают почечную артерию, проводят под нее ограничительную пластинку из пленки какой-либо пластмассы с целью отстранения окружающих тканей, мешающих наложению спирали. Фиксируя удлиненный конец спирали с помощью артериального зажима, вводят (ввинчивают) почечную артерию в спираль. Удлиненный конец спирали обрезают. Вначале на одну почечную артерию накладывают спираль с диаметром витков 0,24-0,26 мм, а через 4-8 недель на другую спираль с диаметром витков 0,35 мм. Спирали изготовляют из нержавеющей проволоки — тантала, нихрома и др. диаметром 0,2-0,3 мм (рис. 39).
Рис. 39. Изготовление сосудосуживающей спирали
Источник