- Крысы-алкоголики подсказали ученым, как можно лечить печень
- Российские ученые обнаружили в печени крыс с хроническим алкоголизмом особую систему митохондрий, которая меняется под действием этанола. Это может пригодиться для разработки новой терапии при алкогольной интоксикации.
- Как проходило исследование
- Что такое митохондрии
- Что открыли ученые
- Почему это важно
- Болезни печени и желчевыводящих путей у грызунов и кроликов
- Морфологические характеристики поражения печени крыс при экспериментальной тиреоидэктомии
Крысы-алкоголики подсказали ученым, как можно лечить печень
Российские ученые обнаружили в печени крыс с хроническим алкоголизмом особую систему митохондрий, которая меняется под действием этанола. Это может пригодиться для разработки новой терапии при алкогольной интоксикации.
Как проходило исследование
Ученые разделили на пары самцов крыс одного возраста и веса, которых содержали в отдельных клетках, оборудованных специальными поилками. Грызуны, получавшие алкогольную диету, имели свободный доступ к поилкам в течение дня; контрольные крысы получали точно такое же количество еды, что и «выпивающие» собратья.
Животным из первой группы постепенно увеличивали количество этанола с пищей, а затем давали корм, содержащий 5% этанола. После этого исследователи выделяли митохондрии из печени крыс и изучали различия в их состоянии контрольной и алкогольной групп.
Что такое митохондрии
Митохондрии — особые компоненты, которые играют важную роль в жизненном цикле клеток организма. Они участвуют в обмене веществ и энергии, встречаясь в клетках разных органов. К примеру, большое количество митохондрий функционирует в клетках печени, которые обладают высокой регенеративной способностью и требуют много энергетических затрат.
Что открыли ученые
Исследуя воздействие этанола на организм крыс, ученые также исследовали реакции на добавки препаратов, потенциально полезных для лечения последствий алкоголизма. Оказалось, что два вещества — PK 11195 и Протопорфирин-IX способны специфически связываться с активным центром белка, который находится на внешней мембране митохондрий и отвечает за перенос холестерина с внешней мембраны на внутреннюю.
Эти вещества показывали эффективность в исследованиях различных заболеваний, в том числе онкологических, и входят в состав некоторых фармацевтических препаратов, но для лечения последствий алкогольной интоксикации до сих пор не применялись.
«Мы обнаружили значительное усиление действия данных препаратов в митохондриях, выделенных из крыс с хроническим алкоголизмом, — говорит старший научный сотрудник лаборатории фармакологической регуляции клеточной резистентности Института теоретической и экспериментальной биофизики РАН Юлия Бабурина. — Например, при добавлении Протопорфирина в митохондриях пристрастившихся к спиртному крыс дыхание не угнеталось, а набухание митохондрий замедлялось».
Ученые предположили, что в митохондриях есть особая система, действующая при возникновении патологий, связанных с алкоголизмом. Протопорфирин и PK 11195 участвуют в регуляции этой системы.
Почему это важно
По словам Юлии Бабуриной, изучение механизма действия веществ станет предметом дальнейших исследований. Уже сейчас результаты работы ученых открывают перспективы применения Протопорфирина IX и PK 11195 для лечения заболеваний, связанных с хронической алкогольной интоксикацией.
Источник
Болезни печени и желчевыводящих путей у грызунов и кроликов
Печень – один из важнейших органов в организме, она участвует во всех метаболических процессах, происходящих в организме. К ее основным функциям относят:
- Обмен белков
- Обмен углеводов
- Обмен липидов
- Обмен витаминов
- Обмен гормонов
- Обмен пигментов
- Обезвреживание токсических веществ
- Иммунная защита
- Кровообращение
- Пищеварительная функция
Поражения печени и желчевыводящих путей составляют значительный процент болезней животных, в том числе грызунов и зайцеобразных, диагностируемых в условиях ветеринарной клиники.
Болезни печени и желчевыводящих путей, встречающиеся у грызунов и кроликов:
- Невоспалительные заболевания — гепатозы (жировой, амилоидный)
- Воспалительные заболевания — гепатиты (острый и хронический, первичный и вторичный)
- Цирроз печени
- Новообразования печени
- Абсцессы печени
- Нарушения кровообращения в печени
Болезни желчевыводящих путей:
- Холецистит — воспаление желчного пузыря
- Холангит — воспаление желчных протоков
- Холелитиаз — образование камней в желчном пузыре
Нередко заболевания могут протекать сочетано.
Наиболее частые причины болезней печени и желчевыводящих путей у грызунов и кроликов:
- Действие токсинов, поступающих с пищей (недоброкачественные корма)
- Действие токсинов, образующихся при неполном переваривании пищи при заболеваниях кишечника
- Паразитарные заболевания (кокцидиоз, лямблиоз, амебиаз, некоторые глистные инвазии)
- Отравление гепатотоксическими веществами, в т.ч. лекарственными препаратами
- Голодание (например, при патологии прикуса)
- Инфекции
- Нарушения белкового, углеводного, жирового обменов веществ, сахарный диабет
- Действие токсинов, возникающих при почечной недостаточности
- Токсические продукты распада белков при больших злокачественных опухолях
Клинические симптомы болезней печени и желчевыводящих путей у грызунов и зайцеобразных:
- Вялость
- Отказ от корма
- Снижение массы тела
- Повышенная или пониженная жажда
- Сухость слизистых оболочек
- Метеоризм
- Диарея
- Запоры
- Дерматиты, кожный зуд, сухость кожных покровов, образование перхоти, алопеции на коже, гиперкератоз
- желтуха
- асцит – скопление свободной жидкости в брюшной полости
- обесцвечивание кала – гипохолия
- изменение цвета мочи (моча цвета «темного пива» или ярко-желтая)
- снижение свертываемости крови и появление кровоизлияний на коже
- коликообразные боли
Диагностику болезней печени проводят комплексно в условиях ветеринарной клиники, включая анамнез, клинические признаки, пальпаторное и перкуторное обследование животного, лабораторные анализы, позволяющие оценить функциональное состояние печени, и дополнительные методы исследования – рентген, УЗИ.
Анамнез жизни — проводится с целью сбора данных о предшествовавшем заболеванию периоде жизни животного.
Владельцам необходимо дать ответы на следующие вопросы:
- возраст животного
- условия содержания
- проведённые вакцинации (для кроликов)
- контакты с другими домашними животными или дикими грызунами
- подробный состав рациона
- имела ли место быть смена рациона и условий содержания
- время и характер проявления болезни
- течение заболевания (резкое или постепенное ухудшение состояния, течение со спонтанными ремиссиями)
- изменение аппетита
- изменение жажды
- изменение каловых масс и мочи
- динамика кондиции животного
- увеличение объёма живота
- изменение поведения животного
- изменение качества шерсти и состояния кожного покрова
При клиническом исследовании обращают внимание на внешний вид животного:
- положение тела животного в пространстве
- конституция
- упитанность
При исследовании слизистых оболочек и кожных покровов особое внимание обращают на:
- наличие иктеричности, анемичности
- склонность к геморрагиям
При пальпации брюшной стенки животного отмечают:
- болезненность
- увеличение размеров печени
- отёки и асциты
- пневматоз ЖКТ
Биохимическое исследование крови (основные показатели, которые оцениваются у грызунов и зайцеобразных при болезнях печени и желчевыводящих путей):
- Общий белок
- Альбумин
- АСТ
- АЛТ
- ГГТ
- ЛДГ
- Билирубин
- Щелочная фосфатаза
Стандартный набор показателей у грызунов включает первые 5 показателей, остальные по усмотрению, если есть возможность взять достаточный объем биоматериала.
Гематологические исследования позволяют выявлять только неспецифические изменения, возникающие при болезнях печени. Выявляют:
- увеличение скорости оседания эритроцитов (СОЭ)
- лейкопению
- лейкоцитоз (нейтрофилию)
- тромбоцитопению
- анемию микроцитарную, макроцитарную или гемолитическую
- изменение величины гематокрита
Исследование мочи проводят на наличие уробилина и специфических кристаллов.
- Уробилин представляет собой желчный пигмент, который является конечным продуктом превращения гемоглобина. Уробилин получается из уробилиногена, который есть в свежей моче.
- В норме уробилин попадает в мочу в ничтожно малых количествах. Но если при лабораторных исследованиях уробилина оказывается больше нормы, такая положительная реакция (от слабоположительной + до резкоположительной +++) говорит о возможном наличии заболеваний печени и желчевыводящих путей:
- циррозы, гепатиты,
- закупорка камнем желчевыводящих путей,
- опухоли,
- отек тканей печени в результате застойных явлений.
- Наличие специфических кристаллов:
- Лейцин и тирозин: выраженное расстройство обмена веществ; отравление фосфором; деструктивные заболевания печени.
- Цистин: врожденное нарушение цистинового обмена – цистиноз; цирроз печени; вирусный гепатит; состояние печеночной комы.
Рентгенографическое исследование используется для оценки размеров печени и обнаружения асцита.
- Опухоли, гипертрофический цирроз, избыточная нагрузка сопровождаются увеличением объёма печени.
- Атрофический цирроз приводит к уменьшению границ печени.
- Показателем патологии печени может служить повышение рентгеновской контрастности органа.
Ультразвуковое исследование используется для:
- определения размера и объёма печени,
- очагов эхогенности,
- визуализации желчных путей,
- определения наличия взвеси или камней в желчном пузыре,
- обнаружения асцита, в т.ч. при небольшом скоплении жидкости
- контроля проведения биопсии печени, но у грызунов и кроликов используется редко.
Тактика лечения болезней печени
1.Устранение или снижение активности этиологического фактора (причина)
2.Детоксикация организма (энтеросгель, энтеродез)
3.Коррекция водного и электролитного баланса (натрия хлорид, рингер, рингер-локка, регидрон, гидровит)
5.Лактулоза (связывание аммиака, слабительный эффект): Дюфалак, Лактусан, Лактофильтрум
6.Гепатопротекторы (Карсил, Гептрал, Эссенциале, Лив52, Хофитол, Гепатовет)
7.Витамины и аминокислоты (Дюфалайт, Гемобаланс)
Тактика лечения болезней желчевыводящих путей
1.Устранение этиологического фактора или снижение его активности
3.Снятие спазмов желчевыводящих путей (но-шпа, папаверин, атропин, бускопан)
4.Желчегонные препараты (Урсофальк, Хофитол, Холензим, Холосас, Тыквеол, кукурузные рыльца)
5.Желчегонные продукты в рационе (листья одуванчика, укроп, шпинат, сельдерей; капуста, помидоры, морковь, топинамбур, свекла, грейпфрут, апельсин, кислые яблоки, овсяные отруби, плоды шиповника)
Профилактика болезней печени и желчевыводящих путей
- Сбалансированное кормление
- Отсутствие в рационе потенциально опасных продуктов, способных вызвать отравление — экзотические фрукты и овощи, сочные корма неизвестного происхождения, особенно в зимне-весенний период
- Профилактические мероприятия (антигельминтики, кокцидиостатики)
- Оптимальные условия содержания, просторная клетка – профилактика ожирения
Высокий процент патологий печени, выявленных в зимнее время, связан с изменением рациона кормления. В данный период в рационе грызунов увеличивается доля концентрированных кормов, а также покупной зелени, овощей и фруктов, которые выращены не в нашей полосе, и в большинстве случаев проходят обработку, чтобы сохранить их свежесть, или выращены с помощью удобрений. Чувствительный пищеварительный тракт грызунов реагирует на подобные изменения. Особенно это видно по обращениям с животными в январе, в период новогодних праздников, когда травоядные животные — морские свинки, кролики, шиншиллы часто становятся жертвами салатов с новогоднего стола – хозяева угощают их шкурками от огурцов, помидорами, зеленью, экзотическими фруктами.
В минимальном количестве патологии печени и желчевыводящих путей выявляются в летнее время, когда преобладает натуральный рацион – свежевысушенное сено, трава, овощи-фрукты с собственного огорода.
У морских свинок патологии, связанные с поражением печени и желчевыводящих путей составляют примерно 20% от общего количества заболеваний, у кроликов около 10%, у крыс и шиншилл около 5% (по данным обращений за 2014 год). У остальных грызунов болезни печени не всегда представляется возможным диагностировать в связи с маленьким размером животного, сложностью взятия анализов крови и проведения УЗИ.
Источник
Морфологические характеристики поражения печени крыс при экспериментальной тиреоидэктомии
Тверской государственный медицинский университет
Введение. Неалкогольная жировая болезнь печени (НАЖБП) в современных популяциях человека выходит на одну из лидирующих позиций по частоте. Она диагностируется у 10-30% населения европейских стран, при этом среди лиц с ожирением или сахарным диабетом частота ее достигает 57-74% [1, 2]. Уже не вызывает сомнений наличие связи НАЖБП с такими заболеваниями метаболической природы, как сахарный диабет, ожирение, атеросклероз. Это делает изучение данной патологии актуальным как в аспекте их коморбидных ассоциаций, так и с учетом возможной преморбидной роли поражения печени в их развитии [3, 4].
Доказательная диагностика НАЖБП базируется на гистологическом выявлении в биоптатах печени мелко- либо крупнокапельной жировой дистрофии гепатоцитов [5, 6], которая клинически выражается как стеатоз, стеатогепатит и стеатофиброз, рассматриваемые как единый стадийно протекающий процесс [7]. С большей или меньшей доказательностью обсуждаются разнообразные механизмы развития жировой дистрофии гепатоцитов и присоединения воспалительных явлений с исходом в фиброз органа. Однако триггерные механизмы этих реакций остаются наименее изученными, в том числе и в связи с диагностикой НАЖБП у человека только на этапе уже сформированных патологических состояний органа.
Указанные факты делают весьма актуальной проблему изучения морфологических изменений в печени, начиная с ранних стадий формирования НАЖБП, что с учетом необходимости выполнения пациентам повторных инвазивных биопсий печени не выдерживает критики с этических позиций (соотношение «польза−вред»). Выходом из положения представляется поиск такой адекватной экспериментальной модели развития жировой дистрофии органа у лабораторных животных, при которой легко будет просматриваться начальная «точка отсчета» дистрофических изменений и само их формирование будет происходить достаточно быстро.
В этом качестве есть смысл изучить влияние тиреоидэктомии на особенности формирования патоморфологических процессов в печени крыс. Механизм биологического действия гормонов щитовидной железы реализуется через связывание с ядерными рецепторами (TR) α и β на уровне генома, хотя известно и их негеномное влияние (на мембрану клетки, цитоплазму и митохондрии) [8]. Наблюдаемые при выключении тиреоидной функции метаболические нарушения касаются преимущественно углеводного и липидного обмена. Накоплено достаточно доказательств, свидетельствующих о наличии связи тиреоидного статуса и инсулинорезистентности [8, 9]. В то же время данные о его взаимосвязи с морфофункциональным состоянием печени представлены в основном единичными клиническими наблюдениями поражения печени при снижении тиреоидной функции 12.
Цель исследования: изучить особенности формирования и морфологические характеристики поражения печени крыс в разные сроки после тиреоидэктомии в качестве воспроизводимой модели экспериментальной жировой болезни печени.
Материалы и методы. Исследование выполнено на 40 лабораторных крысах-самках нелинейной породы массой 140-160 г. Содержание животных и постановка эксперимента проведены в соответствии с требованиями приказов № 1179 МЗ СССР от 11.10.1983 г. и № 267 МЗ РФ от 19.06.2003 г., а также международными правилами «Guide for the Care and Use of Laboratory Animals». Животные были распределены на 2 группы: 1-я (исследовательская — 20 особей), в которой проводилась тотальная тиреоидэктомия; 2-я (группа контроля — 10 особей), в которой проводилась мобилизация щитовидной железы без тиреоидэктомии. Анестезия осуществлялась путем ингаляции животными паров эфира. После обработки операционного поля производился разрез кожи и разведение краев раны на держалках. Тупым способом разводились мышцы, обнажалась трахея, открывая доступ к щитовидной железе. Электрокоагулятором выполнялась коагуляция щитовидных артерий, после чего иссекались обе доли щитовидной железы и перешеек с дополнительной обработкой коагулятором ложа органа. Результатом проведенных манипуляций являлась тиреоидэтомия, обеспечивающая надежный первичный (послеоперационный) гипотиреоз без необходимости дальнейшего контроля гормонального статуса животного. После завершения вмешательства рана послойно зашивалась капроновыми нитями. Контрольным животным мобилизация щитовидной железы выполнялась по описанной выше методике, но без удаления органа. После завершения хирургического вмешательства животные обеих групп помещались в клетки и содержались в стандартных условиях вивария на стандартном рационе.
Выведение животных из эксперимента осуществлялось путем передозировки эфирного наркоза в соответствии с требованиями Европейской конвенции по защите экспериментальных животных 86/609 EEC на сроках эксперимента 4 и 8 недель. Производился забор печени животных, а также осмотр области трахеи в непосредственной топографической близости со щитовидной железой после выполненной тиреоидэктомии для оценки возможности регенерации ткани щитовидной железы. В эти сроки трахея имела нормальное строение, роста тиреоидной ткани на ней выявлено не было.
По стандартным методикам осуществлялась гистологическая проводка полученного материала. Окраска микропрепаратов ткани печени осуществлялась стандартным (гематоксилин-эозин) и специальными красителями: суданом III — для выявления липидов и пикрофуксином по Ван-Гизон — для выявления соединительной ткани.
Результаты. Анализ результатов экспериментального исследования показал, что в контрольной группе животных в срок 4-8 недель обнаруживается типичная морфологическая структура печени. Орган представлен дольками, не имеющими четких границ и разделенными тонкой прослойкой соединительной ткани. Междольковая соединительная ткань печени крысы развита слабо. Паренхима долек образована радиально расположенными вокруг центральной вены печеночными балками. Гепатоциты имеют полигональную форму, цитоплазма выглядит гранулярной и амфофильной с одним, реже двумя ядрами правильной округлой или вытянутой формы. В цитоплазме гепатоцитов содержится гликоген, при окраске суданом III в единичных гепатоцитах выявляются едва различимые липидные капли, расположенные преимущественно перинуклеарно. Портальные тракты представлены триадами: артериола, венула и желчные протоки. Строма портальных трактов содержит единичные макрофаги, гистиоциты, лимфоциты и полиморфно-ядерные лейкоциты. Синусоидальные капилляры внутри долек представляют собой очень мелкие сосуды, стенки их выстланы эндотелием. Лейкоцитарные инфильтраты и соединительнотканные волокна в паренхиме не выявляются.
В исследовательской группе животных к 4-й неделе после тиреоидэктомии в печени крыс обнаружены выраженные дистрофические процессы. Во всех препаратах выявлялась картина белковой (зернистой) дистрофии: гепатоциты выглядели увеличенными в размерах, набухшими, с множеством ацидофильных белковых гранул в цитоплазме, придающих характерный для данного типа дистрофии грубозернистый вид. Ядро в части случаев имело плохо различаемую хроматиновую структуру, в других случаях определялись лишь тени ядер, окрашенные в голубоватый цвет. Границы между клетками определялись неотчетливо.
Помимо зернистой, выявлялась гидропическая дистрофия: резко набухшие гепатоциты с оптически пустой и разряженной цитоплазмой. Контуры клеток хорошо очерчены, ядра расположены преимущественно центрально с явлениями кариопикноза и кариолизиса. Остатки слабоэозинофильной зернистой цитоплазмы располагались вокруг ядер или вдоль клеточных мембран. Гидропическая дистрофия встречалась преимущественно в перицентральных отделах дольки.
К 4-й неделе эксперимента гепатоциты всех крыс содержали липидные капли различного диаметра, преимущественно мелкие. При окраске суданом III хорошо определялись мелкие включения нейтрального жира, расположенные преимущественно перинуклеарно, цитоплазма клеток представлялась как бы равномерно запыленной мелкими зернами, дающими реакцию на жир. При этом ядро оставалось в центре гепатоцита. Такой тип жирового перерождения принято называть мелкозернистым или пылевым. В большинстве образцов ткани печени присутствовали и другие признаки дистрофических изменений − слабая окрашиваемость ядер, распад части клеток. У всех животных жировая дистрофия, имея диффузный характер, была несколько более выражена в перипортальной зоне. Жировые вакуоли выявлялись в 1/3 гепатоцитов, что соответствует первой степени стеатоза. По мнению А.И. Абрикосова и соавт. [13] мелкозернистое ожирение следует называть дегенеративным, так как основой процесса в данном случае является повреждение печеночных клеток.
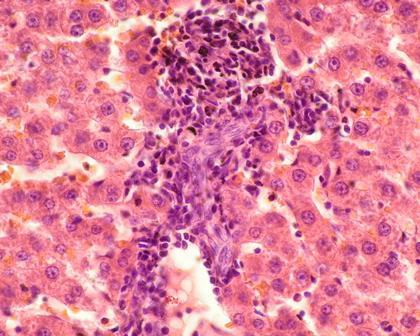
Уже на 4-й неделе эксперимента в ткани печени, чаще в перипортальной зоне, появлялись фокусы воспалительной инфильтрации, представленные скоплением лимфоцитов и плазматических клеток, напоминая гистологическую картину, характерную для хронического гепатита с минимальной активностью (рис. 1).
Рис. 1. Гепатит минимальной степени выраженности. Окраска: Гематоксилин и эозин. Увеличение ×40.
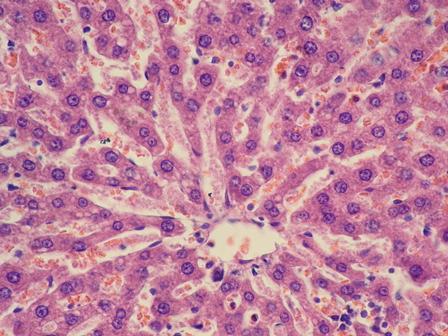
Признаков фибротизации печени в данный срок не выявлено. Гистоархитектоника органа сохраняла нормальное строение. Обращало на себя внимание расширение синусоидов, что является признаком серозного отека (рис. 2).
Рис. 2. Серозный отёк паренхимы. Окраска: Гематоксилин и эозин. Увеличение ×40.
Эритроциты нередко образовывали столбики, типичные для явлений стаза.
Таким образом, уже на 4-й неделе послеоперационного гипотиреоза в печени крыс четко прослеживались грубые дистрофические изменения на фоне серозного отека — белково-жировая дистрофия с признаками хронического гепатита с минимальной активностью.
На 8-й неделе эксперимента патологические процессы в печени претерпевали ряд изменений в связи с прогрессированием дистрофических нарушений. Признаки белковой дистрофии, сохраняясь, имели большую степень выраженности. Цитоплазма гепатоцитов была резко разрежена, грубо зерниста, определялась гипохромия ядер. В большинстве образцов печени выявлялась гидропическая дистрофия, более выраженная, чем в предыдущий срок наблюдения. Цитоплазма клеток прозрачная, характерен подчеркнутый контур гепатоцитов за счет хорошо различимых мембран.
На фоне сохраняющейся пылевидной дистрофии гепатоцитов выявлялись клетки, цитоплазма которых была полностью заполнена нейтральным жиром (рис. 3).
Рис. 3. Мелкокапельная жировая дистрофия. Окраска: судан III. Увеличение ×40.
В большинстве препаратов отмечалась картина хронического гепатита с минимальной степенью активности, однако в указанные сроки после тиреоидэктомии ее выраженность была больше, чем в срок 4 недели.
Поиск признаков фиброза в ткани печени крыс на препаратах, окрашенных по Ван-Гизон, показал разрастание соединительной ткани, расширение крупных портальных трактов за счет утолщения стромы, формирование соединительнотканных тяжей из триад к центральной вене.
Обсуждение. После проведенной тиреоидэктомии у лабораторных животных со сформировавшимся первичным послеоперационным гипотиреозом в печени выявляются изменения, практически полностью воспроизводящие структурные характеристики НАЖБП при метаболическом синдроме. Уже на 4-й неделе послеоперационного гипотиреоза у крыс имеет место отчетливая картина сочетания диффузной мелкокапельной жировой дистрофии с белковой (зернистой) и гидропической дистрофией гепатоцитов, а также фокусов воспалительной инфильтрации преимущественно в перипортальной зоне. Явления белковой дистрофии прогрессируют к 8-й неделе эксперимента одновременно с появлением начальных признаков фиброза органа.
Указанные закономерности, обнаруживаемые на раннем этапе моделирования НАЖБП, заставляют по-новому оценить совокупность патогенетических механизмов ее развития. Выявленная диффузная мелкокапельная жировая дистрофия печени у крыс с первичным послеоперационным гипотиреозом может быть интерпретирована как следствие развивающейся инсулинорезистентности на фоне полного выпадения тиреоидной функции. В условиях инсулинорезистентности нарастает поток свободных жирных кислот (СЖК) через портальную систему печени и, как результат, происходит накопление нейтрального жира в цитоплазме гепатоцитов [14, 15].
Выявленная у экспериментальных животных белковая дистрофия гепатоцитов требует осмысления с точки зрения механизма, ассоциированного с уменьшением синтеза белков печенью, в том числе, входящих в состав липопротеидов, в результате чего замедляется механизм элиминации липидов из гепатоцитов.
Причинами зернистой дистрофии служат гипоксические состояния, а также различные инфекции и интоксикации [16]. Однако факт их наличия исключен условиями постановки настоящего эксперимента, соответственно, ведущим фактором белковой дистрофии выступает гипоксия, наличие которой при гипотиреозе подтверждено многочисленными исследованиями [17, 18].
На фоне белковой дистрофии нарушается синтез липопротеидов (ЛПНП, ЛПОНП), осуществляющих транспорт холестерина, триглицеридов и фосфолипидов из печени к периферическим тканям, и обеспечивающих элиминацию жировых включений из гепатоцитов, а также ЛПВП, которые проявляют антиатерогенные свойства. Выявление сочетания нарушения липидного и белкового обмена может быть рассмотрено как морфологический субстрат атерогенной дислипидемии, наблюдаемой в большинстве случаев у пациентов с гипотиреозом.
Свойственный гипотиреозу дисбаланс анаболических и катаболических составляющих белкового обмена, в том числе касающийся транспортных и структурных белков, способствует повышению восприимчивости клеток к внешним влияниям (нарушение трансмембранного обмена между клеткой и тканевой жидкостью). Кроме того, наблюдается снижение чувствительности тканей к воздействию катехоламинов, что усугубляет дисбаланс обменных процессов.
Выявленная у животных в эксперименте гидропическая дистрофия по существу является отражением нарушений водно-электролитного и белкового обмена, результирующего изменением интрацеллюлярного коллоидно-осмотического давления. Данный патологический процесс протекает с повреждением мембран гепатоцитов и дестабилизацией мембран органелл, в первую очередь − с активацией гидролитических ферментов лизосом и разрывом внутримолекулярных связей с присоединением воды, поэтому гидропическую дистрофию следует рассматривать как проявление очагового колликвационного некроза.
Помимо некротических процессов уже на 4-й неделе после тиреоидэктомии в печени экспериментальных животных обнаруживаются воспалительно-пролиферативные процессы. Подобные изменения наблюдаются в далеко зашедших стадиях метаболических расстройств, характеризующихся нарушением гомеостаза клетки, и свидетельствует о потенциальной возможности развития гепатита и даже цирроза только при действии эндогенных факторов.
Регистрируемая в условиях послеоперационного гипотиреоза в срок 8 недель отрицательная динамика морфологической картины печени крысы, характеризующаяся дальнейшим прогрессированием дистрофических, некробиотических и воспалительно-пролиферативных процессов, убедительно доказывает связь между морфофункциональным состоянием печени и тиреоидным статусом.
Выводы
- Эксперимент с проведением тиреоидэктомии у крыс воспроизводит морфологическую картину жировой дистрофии печени, соответствующую основным характеристикам изменений, свойственных неалкогольной жировой болезни печени, убедительно доказывая взаимосвязь между морфофункциональным состоянием органа и тиреоидным статусом.
- В ранние сроки после развития послеоперационного гипотиреоза в печени экспериментальных животных имеет место сочетание жировой и белковой дистрофии гепатоцитов с проявлениями колликвационного некроза, гепатита с минимальной активностью и начальными признаками фиброза печени.
- С увеличением срока после тиреоидэктомии наблюдается прогрессирование дистрофических и некротических процессов в гепатоцитах, а также последовательное появление признаков трансформация стеатоза в стеатогепатит и стеатофиброз печени.
- Экспериментальные данные о структурных особенностях печени позволяют прояснить некоторые морфологические и патогенетические аспекты формирования жировой болезни печени при первичном (послеоперационном) гипотиреозе для оптимизации диагностических и лечебных подходов к ведению данной категории больных.
Источник