Заболевания кожи у грызунов и кроликов
Жалобы на проблемы с кожей и шерстью являются одной из частых причин обращения в клинику с кроликами, морскими свинками, крысами, хомяками, шиншиллами и другими грызунами. Некоторые заболевания кожи, такие как новообразования (злокачественные или доброкачественные), абсцессы и т.д., требуют в основном хирургического лечения, и в этой статье подробно рассматриваться не будут.
Остановимся подробнее на проблемах кожи и шерсти у грызунов и кроликов. Симптомы могут быть разнообразными:
- питомец сильно линяет
- тусклая шерсть
- перхоть
- расчесы на коже
- алопеции
- зуд.
Изначально, в большинстве случаев подобные проблемы владельцы пытаются решить самостоятельно, связывая эти нарушения с нехваткой витаминов, аллергией на корм или подстилку, и так далее. И вот тут начинаются действительно серьезные проблемы. Животному упаковку за упаковкой меняют корм, добавляют в поилку витамины, экспериментируют с подстилкой, моют различными шампунями – а ситуация тем временем усугубляется: повышенная линька перерастает в выпадение клоков шерсти и появление обширных алопеций, небольшие участки с перхотью превращаются в струпья, а от постоянного зуда животное становится беспокойным, не дает до себя дотрагиваться, худеет, отказывается от еды…
А все потому, что для эффективного лечения заболеваний кожи в первую очередь требуется диагностика.
Владельцам грызунов и кроликов следует знать, что пищевая и контактная аллергия у этих видов животных, в отличие от собак и кошек, встречается исключительно редко.
Истинные причины могут быть разнообразны: паразитарные, грибковые, бактериальные инфекции, гормональные нарушения и еще масса различных факторов. Все это может вызывать схожие симптомы, но лечение абсолютно разное – универсальных средств от всех болезней не существует! Кроме того, некоторые заболевания кожи кроликов, морских свинок, хомяков, крыс, шиншилл могут быть заразны для людей и других животных. Заболевания кожи могут быть сочетанными, когда паразитарные инфекции осложняются грибковыми на фоне снижения иммунитета, или появляются очаги вторичной бактериальной инфекции в местах расчесов. Требуется комплексный подход к диагностике и лечению. Поэтому если ваш питомец проявляет признаки беспокойства, чешется, обильно линяет, если вы обнаружили расчесы на коже кролика, свинки, хомячка или крысы, если в шерсти присутствуют чешуйки и перхоть, имеются алопеции, покраснения кожи, — следует обратиться на прием к специалисту.
Благодаря накопленному опыту по работе со специфическими заболеваниями у грызунов и кроликов, успешно диагностируется и лечится широкий спектр заболеваний:
- высококонтагиозные болезни (лишай)
- различные микозы кожи
- акариазы — заражение микроскопическими клещами (демодекоз, саркоптоз, хейлетиеллез)
- эктопаразитозы (вши, власоеды, блохи)
- дерматиты различной этиологии и прочие заболевания кожи
- патологии, связанные с нарушением обмена веществ, провоцирующие дерматологические заболевания.
Можно привести список чаще всего диагностируемых заболеваний кожи и шерсти у грызунов и кроликов:
- Кролики: хейлетиеллез, контактные дерматиты (чаще всего вследствие неправильного содержания)
- Морские свинки: триксакароз («подкожный клещ»), различные микозы кожи, власоеды, алопеции вследствие гормональных нарушений
- Крысы: патологии кожи при микоплазмозе, власоеды, вши
- Шиншиллы: трихофития, микроспория
- Хомяки: демодекоз, различные микозы кожи
- Дегу: власоеды, трихофития
Диагностика болезней кожи начинается со сбора анамнеза. На приеме у специалиста будьте готовы ответить на ряд вопросов, касающихся возраста животного, обстоятельств его приобретения, подробно описать условия содержания, кормления, болел ли ваш питомец какими-либо заболеваниями, напрямую не связанными с патологией кожных покровов, имелись ли контакты с другими животными.
В случаях, когда при осмотре не выявлено однозначных признаков какого-либо заболевания, на помощь приходит лабораторная диагностика. Изучение поврежденной шерсти, отпечатков и соскобов с кожи позволяет достоверно установить причину заболеваний кожи у грызунов и кроликов. Это очень важно при назначении эффективного лечения, направленного на скорейшее выздоровление вашего питомца.
Лабораторная диагностика: эктопаразиты и дерматофиты
При выборе схемы лечения паразитарных заболеваний очень важно знать жизненный цикл паразита. Это поможет подобрать оптимальный интервал обработок и их длительность. Придерживаясь схемы, назначенной специалистом, ваш питомец поправится так скоро, как это возможно. Однако следует знать, что некоторые заболевания кожи требуют длительной терапии, которую не стоит прерывать при первых признаках улучшения, без консультации с врачом. Прерванный раньше времени курс лечения может спровоцировать рецидив – возвращение заболевания. Чтобы этого не допустить, строго следуйте рекомендациям специалиста.
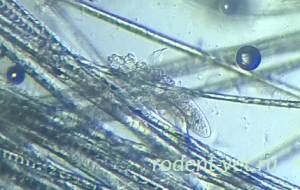
«Подкожный клещ» у морской свинки, осложненный вторичной грибковой инфекцией:
Источник
Заболевания
Клещи
Крысиный клещевой дерматит
Данная статья адресована специалистам, занимающимся дезинфекционной деятельностью, руководителям объектов оптовой и розничной торговли, продовольственных рынков, объектов, связанных с переработкой и хранением пищевых продуктов (мясокомбинаты, магазины, продовольственные базы, столовые, кафе, рестораны, клубы и т.д.); специалистам служб ЖКХ, организаций по удалению бытовых отходов, эксплуатирующих организаций, в ведении которых находятся жилые дома, рынки; специалистам учреждений, связанных с содержанием и разведением животных ( детские зооуголки, зоопарки, виварии, лаборатории с экспериментальными животными, питомники); руководителям и сотрудникам префектур, районных управ и муниципалитетов, а также жителям столицы.
Крысиный клещевой дерматит — паразитарное заболевание человека, вызываемое специфическим эктопаразитом крыс — гамазовым крысиным клещом.
В последние годы ККД стал проблемой практического здравоохранения, особенно в городских условиях. Стихийное возникновение торговых точек, продовольственных рынков, свалок и т.д., наряду с переходом дез. службы на коммерческую основу, создали благоприятные условия для увеличения численности крыс и мышей, что привело к более частому проникновению синантропных грызунов в жилые и производственные помещения.
Основным хозяином крысиного клеща является серая крыса, но в условиях города возможно размножение и питание на домовых мышах. Отличительной чертой, определяющей эпидемиологическую значимость, является его способность питаться на человеке, а также на домашних животных — собаках и кошках. Большую часть жизни клещи проводят вне тела хозяина. В помещениях они распределяются неравномерно и образуют скопления в регулярно посещаемых грызунами местах (в местах ввода коммуникаций, на участках полов и стен вблизи отопительных приборов, около лазов крыс).
Массовое размножение крысиного клеща и возникновение очагов ККД в условиях города (теплое помещение, обилие корма) происходит в течение всего года. Но наибольшее число очагов наблюдается весной, что сопряжено, в значительной степени, с особенностями биологии серой крысы.
Существует 2 типа очагов крысиного клещевого дерматита: бытовые и производственные.
Бытовые очаги как правило приурочены к первым и вторым этажам жилых зданий. Особенности клиники в бытовых очагах связаны с более низкой численностью клещей, их распределением в квартирах и образом жизни семьи. Поражение происходит в любое время суток, наиболее интенсивно — у лиц длительно пребывающих в квартире (пенсионеры, неорганизованные дети, неработающие).
Производственные очаги — это объекты связанные с содержанием и разведением животных (виварии, зоопарки, лаборатории), объекты, связанные с переработкой и хранением пищевых продуктов (мясокомбинаты, рынки, продовольственные базы, магазины и т.д.), служебные помещения административного и производственного назначения.
В условиях производства ККД приобретает все признаки профессионального заболевания: единый этиологический фактор, массовость поражения, однотипность проявлений, преобладание высыпаний в местах контакта с зараженными предметами труда, улучшение клинических проявлений в выходные дни, полное разрешение высыпаний в период отпусков, возобновление болезни при возвращении на работу. Независимо от профессии поражаются все лица работающие в очаге.
Таким образом, для производственных очагов в целом характерна высокая численность крыс и клещей, единовременность поражения больших групп людей. Вследствие высокой численности и частого нападения клещей на людей, заболевание протекает остро.
При нападении и питании на человеке крысиный клещ вызывает дерматит — воспалительную реакцию кожи на кровососание. Появлению первых симптомов предшествует ощущение ползания по коже, чувство жжения, затем появляется зуд. Зуд мучительный, усиливающийся при расчесывании, прикосновении одежды и горячих водных процедурах. Зуд не связан с определенным временем суток, а зависит от времени, которое человек проводит в зараженном клещами помещении. При прекращении контакта с клещами зуд ослабевает через 7-10 дней. В местах кровососания клещей возникают высыпания. Полиморфизм высыпаний зависит от численности крысиного клеща, частоты нападения и индивидуальной реакции кожи больного.
Клещи способны сосать кровь на любом участке кожного покрова, но в большей степени поражают верхнюю часть тела в местах плотного прилегания одежды (лямок, бретелек, пояса, воротника), где группируются высыпания. Клещи предпочитают питаться в местах с тонкой и нежной кожей.
Лечение ККД направлено на устранение зуда и воспалительной реакции, возникшей в местах кровососания клещей. Оно эффективно только при устранении крысиного клеща. Внутрь назначают антигистаминные, десенсибилизирующие препараты, наружно — анилиновые красители.
Система мероприятий по профилактике и ликвидации очагов ККД включает в себя: обследование очага, дезакаризационные мероприятия, дератизационные мероприятия, регистрацию очага.
Показаниями к обследованию очага служат: наличие крысиных клещей в жилых помещениях, подвалах, складах и т.п.; выявление больных ККД и очагов размножения клещей, а также обращение больных с дерматитом неясной этиологии при подозрении на ККД.
Для выявления клещей в помещении используют: метод визуального обнаружения клещей в местах, регулярно посещаемых грызунами; проводят сбор проб пыли из определенных мест в помещении, заселенном клещами, с последующем изучением проб в лаборатории.
Обработку очагов от грызунов и клещей следует проводить после предварительного обследования его врачом-дезинфектологом (или инструктором-дезинфектором), не позднее 2-х дней после поступления жалоб на укусы клещей. В случае затруднений с определением клещей следует обратиться за помощью к энтомологу ФГУЗ «Центр гигиены и эпидемиологии в городе Москве» или в филиалы ФГУЗ «Центр гигиены и эпидемиологии в городе Москве» в АО.
Дезакаризации подлежат все помещения, где были выявлены больные ККД и обнаружены крысиные клещи. В обязательном порядке обрабатывают места проникновения и перемещения грызунов внутри помещений: ввод коммуникаций, коммуникационные каналы, плинтусы с прилежащими участками пола и стены на высоту 1 м. от поверхности пола, а также места возможного скопления клещей — обогреваемые участки стен и полов около отопительных приборов и тепловых коммуникаций. При наличии животных особое внимание уделяют местам их кормления и отдыха (подстилки, диваны, кресла, столы).
Дератизационные мероприятия включают борьбу с синантропными грызунами на объектах при появлении там крысиных клещей, контроль за численностью и распределением грызунов, выявление и своевременная заделка лазов крыс в жилых помещениях, контроль за санитарно-техническим состоянием объектов (особенно пищевых), привлекающих грызунов.
В целях личной профилактики ККД при работе в условиях лаборатории, в вивариях, в очагах массового размножения клеща целесообразно использовать репелленты («Биозащита», «Акрофтал», «Фталар» и др.)
Нормативная база:
1. Методические рекомендации по организации борьбы с крысиным клещем М., 2001г.
2. Методические рекомендации по борьбе с крысиным клещем, профилактике и лечению крысиного клещевого дерматита. М., 1993 г.
3. СП 3.5.3.1129-02 «Санитарно-эпидемиологические требования к проведению дератизации»
4. СанПин 3.5.2.1376-03 «Санитарно-эпидемиологические требования к организации и проведению дезинсекционных мероприятий против синантропных членистоногих»
5. СанПиН 2.1.2.1002-00 «Санитарно-эпидемиологические требования к жилым зданиям и помещениям»
6. Постановление Главного государственного санитарного врача РФ №12 от 28.12.04. «О повышении эффективности контрольно-надзорных мероприятий в сфере жилищно-коммунального хозяйства»
По материалам журнала «СЭС. Информация по тел. 508-3383
Источник
Влияние комбинированного препарата глицирризиновой кислоты и глутамил-триптофана на течение контактного дерматита у крыс
В.С. Смирнов 1 , Т.Н. Саватеева-Любимова 2 , А.В. Саватеев 2
1 ООО «ЦитоНИР» 191023, Санкт-Петербург, Мучной пер., д. 2
2 ФГБУН «Институт токсикологии Федерального медико-биологического агентства» 192019, Санкт-Петербург, ул. Бехтерева, д. 1
Скачать PDF
Цель. В эксперименте на крысах планировали оценить влияние топического препарата Тиладерм, в состав которого включены глицирризиновой кислоты натриевая соль и глутамил-триптофана натриевая соль, на течение контактного дерматита (КД).
Материал и методы. Исследование проводили на белых крысах Вистар. КД индуцировали аппликацией спиртово-ацетонового раствора 2,4-динитрохлорбензола (ДНХБ) в течение 4 дней. Затем на индуцированный ДНХБ очаг поражения кожи 1 раз в день в течение 14 дней наносили композицию глицирризиновой кислоты и глутамил-триптофана в мазевой основе типа «масло в воде». Тяжесть КД оценивали по состоянию очага поражения, морфологическому составу крови и показателям апоптоза в очаге.
Результаты. Аппликации раствора ДНХБ привели к развитию у крыс КД, проявившегося папуловезикулярными высыпаниями, экскориациями, корками на поверхности очага. Использование топического препарата Тиладерм позволило снизить время регресса поражения кожи, происходившего уже к концу 14-го дня лечения. Показано, что в очаге КД наблюдалась активация маркеров апоптоза (Ki-67, в меньшей степени — p53, каспаза-3, bcl-2). На фоне лечения препаратом Тиладерм экспрессия Ki-67 снижалась, а экспрессия p53 и каспазы-3 — увеличивалась.
Выводы. Препарат Тиладерм проявил отчетливое позитивное действие на течение экспериментального КД у крыс.
Характерной чертой современной цивилизации является нарастание интенсивности воздействия ксенобиотических факторов окружающей среды на организм человека. химическая промышленность синтезирует огромное количество различных токсичных соединений, используемых в производстве химических красителей, синтетических волокон, средств для борьбы с вредителями [1]. В той или иной мере токсичные продукты химических производств могут попадать во внешнюю среду, продукты питания, воду и т. д. и воздействовать на организм человека. Результатом этого воздействия является устойчивая тенденция к увеличению числа заболеваний токсико-аллергической природы и, в частности, к появлению контактных дерматитов (КД), для которых характерно хроническое течение и устойчивость к терапии [2].
В этой связи особую актуальность приобретает поиск новых средств лечения таких состояний. Одним из таких направлений является поиск новых препаратов противовоспалительной и иммуномодулирующей направленности, таких как производные солодки [3, 4], и иммунорегуляторных пептидов-тимомиметиков, в частности дипептида глутамил-триптофан [5]. Ранее нами уже было показано, что глицирризиновая кислота и глутамил-триптофан по отдельности и особенно в комбинации изменяют процессы апоптоза в очаге КД, развившегося в ответ на аппликацию 2,4-динитрохлорбензола (ДНхБ) [6]. Выявленные изменения можно было трактовать как процессы репарации острого повреждения кожи, вызванного токсическим воздействием ДНхБ.
Целью настоящей работы явилась оценка влияния топического препарата Тиладерм, в состав которого включены глицирризиновой кислоты натриевая соль и глутамил-триптофана натриевая соль, на течение КД, индуцированного ДНхБ.
Материал и методы
эксперименты проведены на 60 крысах-самцах Вистар с массой тела 200—220 г, выращенных в питомнике РАН «Рапполово». До эксперимента животных подвергали 14-дневному карантину и рандомизации. Животных содержали в условиях вивария на стандартном рационе. эксперименты выполняли согласно существующим требованиям лабораторной практики [7, 8].
Моделирование КД. Контактный дерматит (КД) воспроизводили по модифицированной методике п.М. залкан и Е.А. Иевлева [9] путем двукратных аппликаций ДНхБ, который наносили в виде 5% спиртово-ацетонового раствора на выстриженные участки боковой поверхности тела крыс в течение 4 дней.
Схема эксперимента. Все животные случайным образом были разделены на 4 группы:
- интактные животные, не подвергавшиеся никаким воздействиям, — 6 крыс;
- контрольная группа (контроль) — животные с воспроизведенным КД без лечения — 18 крыс;
- опытная группа (Тиладерм) — животные с воспроизведенным КД с ежедневным нанесением на очаг поражения препарата Тиладерм — 18 крыс;
- группа сравнения (плацебо) — животные с воспроизведенным КД с ежедневным нанесением на очаг поражения только мазевой основы — 18 крыс.
Спустя 4 сут. после первой аппликации ДНхБ на образовавшиеся очаги поражения КД начинали наносить препарат Тиладерм, представляющий собой фармакологическую композицию, содержащую 2% глицирризиновой кислоты тринатриевой соли и 0,05% глутамил-триптофана натриевой соли в мазевой основе. В качестве плацебо использовали мазевую основу, не содержавшую активных компонентов.
Препараты наносили ежедневно 1 раз в сутки в течение 14 дней. На протяжении всего эксперимента ежедневно оценивали тяжесть развившегося дерматита по изменению показателей кожного покрова — величины кожной складки и тяжести кожных проявлений. Тяжесть кожных проявлений выражали в баллах: 0 — отсутствие реакции; 0,5 — появление локальных очагов гиперемии; 1 — выраженная гиперемия; 2 — гиперемия и отечность; 3 — резкое покраснение и отек; 4 — образование эрозий; 5 — образование геморрагической корки.
Величину скорости оседания эритроцитов (СОэ), количество лейкоцитов и процентное соотношение субпопуляций ядросодержащих клеток в периферической крови определяли по общепринятым методам.
Экспрессию маркеров апоптоза — белков p53, bcl-2, cpp32 (caspase-3), Ki-67 определяли в парафиновых срезах биоптатов кожи в помощью двухэтапного авидин-биотинового метода с использованием антител к p53, bcl-2, cpp32, Ki-67 и визуализирующей системы фирм Dako и Novocastra по методикам производителя. Интерпретацию результатов проводили с помощью светового микроскопа полуколичественным методом, в котором интенсивность иммунопозитивной реакции оценивали степенью интенсивности окраски — отрицательная (—), положительная (+). Результат выражали в виде доли окрашенных клеток (в каждом случае определяли в 3 сериях наблюдения, подсчет вели в 100 клетках каждой серии).
Общая продолжительность наблюдения после моделирования КД составляла 14 дней. Оценку тяжести проявлений в очаге КД и измерение толщины кожной складки производили ежедневно. показатели периферической крови определяли перед началом терапии, а также на 7-й и 14-й дни лечения. показатели апоптоза в разных слоях кожи в очаге КД определяли однократно на 14-й день терапии.
Статистическая обработка. полученные результаты обрабатывали с использованием статистической программы Statistica 6.0. Различия между выборками оценивали с помощью критериев Манна — Уитни, Крускала — Уоллиса. Для проведения статистических расчетов использовалась программа Microsoft Excel 2003.
Результаты обсуждения
К исходу 4-суточного периода аппликаций ДНхБ на коже крыс формировался очаг КД, характеризовавшийся папуловезикулярными высыпаниями, экскориациями и образованием толстой, плотной и глубокой геморрагической корки (рис. 1). В зоне очага и прилегающих участках кожи развивались отек и инфильтрация клетками воспалительного ряда, что проявлялось увеличением кожной складки, толщина которой достигла 4,5—5,0 мм, в то время как у интактных животных она составляла 2,0—2,1 мм (различия достоверны при р
Источник