- Шрамы на легких: пульмонолог о том, как предотвратить фиброз после ковидной пневмонии
- Опасности вирусного воспаления
- Рубцы могут вызвать дыхательную недостаточность
- Займитесь лечебной гимнастикой
- Треть тестов — ложноотрицательные
- Есть ли риск повторно заразиться
- Реабилитация пациентов
- Советы по профилактике
- Новые подходы к лечению фиброзирующих интерстициальных заболеваний легких
Шрамы на легких: пульмонолог о том, как предотвратить фиброз после ковидной пневмонии
Ситуация с ковидом, утверждают медики, более-менее стабилизировалась. Но впереди еще два холодных месяца, и как они пройдут, никто точно не знает. Слишком коварен, непредсказуем и стремителен коронавирус. И порой тем, кто перенес болезнь в тяжелой форме, предстоит длительное восстановление. Ковид бьет по всем системам организма, особенно по легким, в которых впоследствии могут образовываться рубцы. Чем опасен фиброз, как его лечить, какая реабилитация требуется переболевшим «короной» — на эти и другие вопросы «Амурской правды» ответила врач-пульмонолог Дальневосточного научного центра физиологии и патологии дыхания, кандидат медицинских наук Юлия Семиреч.

Фото: Андрей Ильинский
Опасности вирусного воспаления
— Юлия Олеговна, коронавирус часто поражает легкие. Чем все-таки эти пневмонии отличаются от бактериальных?
— От бактериальных пневмоний они отличаются прежде всего распространенностью и характером воспаления. Как правило, это двусторонние полисегментарные пневмонии. К термину «ковидная пневмония» даже больше подходит термин «вирусный ковидный пневмонит». Такое воспаление в легких протекает иначе — с развитием интерстициального воспаления (то есть затрагивающего стенки альвеол и соединительную ткань легкого. — Прим. ред.) и тромбозом мелких легочных сосудов, формированием такого осложнения, как пневмофиброз. И требует более длительного лечения, чем при бактериальной пневмонии, раннего начала реабилитационных мероприятий и продолжения их даже в период долечивания и выздоровления.
— Что происходит в легких при ковидной пневмонии?
— На фоне вирусной инфекции происходит повреждение стенки легочной альвеолы, легочного интерстиция (соединительной ткани. — Прим. ред.), участвующих в газообмене мелких сосудов (что вызывает васкулит, микротромбоз). Характер воспаления иной, нежели при бактериальных пневмониях — там альвеолы заполнены жидким или гнойным секретом, а здесь такого нет. Для утяжеления бактериальной пневмонии требуется определенное время, а при вирусных пневмониях поражение легких может носить молниеносный характер и приводить в дальнейшем к выраженному фиброзу. Риск развития фиброза в легких выше у пациентов с обширными поражениями легких, у тех, кто прошел ИВЛ, у больных, имеющих сопутствующую патологию (сахарный диабет, ожирение, гипертонию).
Фиброз в легких может сопровождаться постоянным кашлем, быстрой утомляемостью и плохой переносимостью обычных физических нагрузок.
Течение ковидных пневмоний непредсказуемо, нельзя заранее сказать, как будет протекать заболевание у того или иного человека. Иногда пневмония с изначально небольшим поражением легких носит тяжелое течение, со стремительно нарастающими симптоматикой и объемом повреждения легочной ткани, вплоть до угрожающих жизни осложнений и летального исхода.
Рубцы могут вызвать дыхательную недостаточность
— Расскажите подробнее про фиброз. Какие еще бывают осложнения после ковида?
— Основная мишень коронавирусной инфекции — это легкие, следовательно, вирусная пневмония, особенно тяжелая, с большим объемом поражения, инвазивной вентиляцией легких в процессе лечения может закончиться фиброзом в легких. Фиброз — это последствия воспалительного процесса, когда легочная ткань замещается соединительнотканным рубцом. Если говорить обычным языком, это шрам на легком. Если он небольшого размера, то на легочную функцию и газообмен не повлияет. Если же фиброз обширный, двусторонний, с поражением нескольких сегментов или даже долей, то в дальнейшем это может привести к необратимым изменениям легочной функции, дыхательной недостаточности, вплоть до инвалидизации.
Юлия Семиреч объясняет: вирусная пневмония имеет определенные рентгенологические особенности, так называемый симптом «матового стекла». Даже если тест на COVID отрицательный, по КТ органов грудной клетки можно с высокой степенью уверенности определить ковидную пневмонию.
— Как проявляется фиброз?
— После перенесенного ковида пациенты жалуются на одышку при обычной физической нагрузке, она не проходит в течение нескольких недель и даже месяцев (еще одышка может быть проявлением постковидного астенического синдрома). Также фиброз в легких может сопровождаться постоянным непродуктивным кашлем, быстрой утомляемостью, плохой переносимостью обычных физических нагрузок. Наиболее информативным методом, позволяющим оценить распространенность фиброза, является компьютерная томография органов грудной клетки. Кроме того, врачи назначают бодиплетизмографию (исследование соотношения разных легочных объемов), спирометрию (метод, позволяющий оценить объем вдыхаемого и выдыхаемого воздуха. — Прим. ред.), так как жизненная емкость легких при пневмофиброзе может быть снижена.
Займитесь лечебной гимнастикой
— Если фиброз — воспалительная стадия в легких, значит, можно постараться ее избежать?
— Как я уже говорила, нельзя сказать, что у этого пациента стопроцентно сформируется фиброз, а у другого его не будет. Но чем больше степень поражения легких, тем выше риск развития фиброза. Поэтому во время лечения очень важно соблюдать все предписания врача, иметь позитивный настрой на выздоровление, еще на госпитальном этапе начать реабилитационные мероприятия и продолжать курс на амбулаторном этапе и этапе долечивания. Это может занять от нескольких недель до нескольких месяцев.
— Есть ли эффективные методы профилактики фиброза?
— Так как высокоэффективных, универсальных лекарственных препаратов для профилактики фиброза нет, необходимо как можно раньше начать немедикаментозные методы профилактики. Прежде всего — это лечебная дыхательная гимнастика. Дыхательных техник много: лечебная гимнастика по Стрельниковой, Бутейко, йоговское дыхание. Можно использовать дыхательные тренажеры, сделанные самостоятельно: выдувание воздуха через трубочку в стакан с водой. Делать это упражнение по 10 минут три раза в день.

Следует заметить, что любимое многими дыхательное упражнение — надувание воздушных шариков — в остром периоде болезни запрещено, так как существует риск повреждения воспаленной легочной ткани, вплоть до развития пневмоторакса. Зато очень полезен в период долечивания массаж грудной клетки, физиотерапевтические процедуры (но с учетом противопоказаний).
— Полезны ли физические нагрузки и что нельзя делать в период восстановления?
— Физические нагрузки должны быть дозированными. В период долечивания очень полезны пешие прогулки, скандинавская ходьба (где задействован верхний плечевой пояс, движения способствуют улучшению дренажной функции и кровотока в легких). А вот тяжелые физические нагрузки однозначно следует избегать, так как организму нужно дать время на восстановление после тяжелой инфекции. Запрещено также дышать эфирными маслами, которые могут оседать в легких, нарушая кровоснабжение и газообмен в них. Нельзя дышать агрессивными нелекарственными препаратами, спиртовыми растворами, содой. А люди у нас очень любят заниматься самолечением. Кстати, многие из тех, кто тяжело перенес ковид, впоследствии бросают курить — из-за выраженного дыхательного дискомфорта и одышки. Причем даже курильщики со стажем.
Треть тестов — ложноотрицательные

— Почему у пациентов с большим поражением легких (60—70 процентов) тесты на ковид отрицательные?
— К сожалению, ложноотрицательные тесты не редкость. Примерно каждый третий пациент с пневмонией у нас с ложноотрицательным ПЦР-тестом на COVID-19, причем есть больные, которым это исследование проводилось неоднократно. Причин может быть несколько: нарушение сроков и техники взятия мазков, неподготовленность пациента (необходимо соблюсти определенные условия). При развитии ковидной пневмонии тесты вполне могут показывать отрицательный результат, потому что вирус уже проник далеко в нижние дыхательные пути и в верхних, откуда берется мазок, его может уже и не быть.
Примерно у каждого третьего пациента с пневмонией ПЦР-тест на COVID-19 показывает ложноотрицательный результат.
— На что врачи тогда ориентируются при назначении лечения?
— Дело в том, что рентгенологически вирусные пневмонии отличаются от бактериальных. И по снимку можно с высокой степенью уверенностью сказать, что это пневмония ковидная. Она имеет определенные рентгенологические особенности, так называемый симптом «матового стекла», изменения носят двусторонний характер, располагаются субплеврально и затрагивают несколько сегментов легких. Кроме того, пациенты описывают характерные для коронавирусной инфекции симптомы, которые невозможно перепутать с другими вирусными заболеваниями. Все пациенты говорят: «Так болели первый раз в жизни». Если пациент хочет убедиться, что перенес именно коронавирусную пневмонию, мы рекомендуем ему сдать анализ на антитела. И у 99 процентов больных эти антитела выявляются.
Есть ли риск повторно заразиться
— Правда ли, что после перенесенной коронавирусной пневмонии человек может повторно заболеть ею?
— Есть данные о том, что первые 6—8 месяцев после перенесенной ковидной пневмонии люди защищены от повторного заражения, у них вырабатываются антитела и формируется иммунитет. К слову, у нас еще есть и другой вид иммунитета — клеточный, который тоже защищает от вирусных инфекций. В моей практике пока не встречались пациенты, которые бы заболели коронавирусом повторно. Хотя слышала, что такие случаи бывают. Нужно понимать, что на фоне ослабленного иммунитета после коронавируса можно заразиться любой другой вирусной инфекцией, которые никуда не исчезли из нашей жизни и сезонно распространяются.
— Сегодня идет вакцинация против ковида. Поставите ли вы прививку?
— Поставлю, но позже, потому что уже переболела коронавирусной инфекцией (в моей семье все переболели). Количество вирусных пневмоний сейчас идет на спад, я вижу, что пациентов стало меньше, чем было до Нового года, и думаю, что мы все-таки не выйдем на третью волну, а благополучно выберемся из этой сложной эпидситуации. Значимую роль в этом, конечно, сыграет и вакцинация.
По КТ органов грудной клетки врачи могут с высокой степенью уверенности сказать, что пневмония — коронавирусная, даже при отрицательном тесте на COVID-19.
Тем, кто не переболел коронавирусом, вакцинироваться нужно. Защититься от инфицирования крайне сложно, как и спрогнозировать течение коронавирусной инфекции. Я считаю, что риск развития осложнений от вакцинации ниже, чем риск тяжелого течения коронавирусной инфекции и ее осложнений. А с осложнениями в своей практике я встречаюсь каждый день, и это не только пневмонии, но еще и миокардиты, перикардиты, нарушения сердечного ритма, полинейропатии, невропатии лицевого нерва, венозные тромбозы и другое.
Реабилитация пациентов
— Проводится ли реабилитация пациентов после ковида на базе Дальневосточного научного центра физиологии и патологии дыхания?
— Да, у нас разработан хороший реабилитационный комплекс. Мы используем лечебную гимнастику, массаж грудной клетки, физиотерапевтические процедуры, при необходимости лекарственную терапию. Это не только больные после перенесенной пневмонии, а пациенты с послековидным астеническим синдромом, нетяжелыми послековидными осложнениями со стороны нервной, сердечно-сосудистой системы.
— Кому могут отказать в реабилитации?
— В случае, если пациент не подходит под программу реабилитации. Если имеются декомпенсированные хронические заболевания легких, сердца, нарушения ритма, любые острые заболевания до момента выздоровления. Уже около 100 человек прошли у нас реабилитационный курс. Спрос большой, в январе велась запись на февраль. Эффект от реабилитации хороший. Многие пациенты отмечают, что у них появились физические силы, уменьшилась одышка, улучшилось самочувствие, нормализовался сон.
Советы по профилактике
Чтобы уберечься от ковидной пневмонии и других легочных инфекций, необходимо:
— ежегодно вакцинироваться от гриппа, привиться от коронавирусной инфекции, в дальнейшем поставить прививку от пневмококковой инфекции (пневмококк — самый частый возбудитель бактериальных пневмоний);
— отказаться от курения — чем меньше агрессивное воздействие на дыхательные пути, тем лучше;
— своевременно санировать хронические очаги других инфекций;
— заниматься спортом по возможности, вести активный образ жизни (спортсмены редко болеют тяжелой ковидной пневмонией, и у них обычно не остается фиброзных изменений в легких);
— правильно и полноценно питаться, принимать профилактические курсы витаминов и минеральных комплексов;
— увлажнять воздух в доме;
— продолжать носить маски, обрабатывать руки антисептиком, избегать массового скопления людей.
Источник
Новые подходы к лечению фиброзирующих интерстициальных заболеваний легких
Фиброзирующие варианты поражения легких, приводящие к развитию дыхательной недостаточности, относятся к числу наиболее тяжелых интерстициальных заболеваний легких. Помимо идиопатического легочного фиброза, они включают в себя хронический гиперсенситивный пневмонит, неспецифическую интерстициальную пневмонию, поражение легких в рамках системных заболеваний соединительной ткани, неблагоприятные варианты течения легочного саркоидоза и некоторые другие. Применяющаяся для лечения этих заболеваний иммуносупрессивная терапия у части пациентов оказывается неэффективной и сопряжена с высоким риском тяжелых нежелательных явлений. Изучение новых лекарственных препаратов с антифиброзным действием, в частности нинтеданиба, открывает новые возможности для лечения этой непростой группы больных.
С.В. Моисеев. Среди хронических интерстициальных заболеваний легких (ИЗЛ) наиболее тяжелыми являются варианты поражения легких, протекающие с формированием выраженного фиброза и, следовательно, дыхательной недостаточности. Хотя механизмы образования соединительной ткани при этих заболеваниях были достаточно хорошо изучены, терапевтические подходы к торможению фиброгенеза до недавнего времени оставались мало эффективными, а широко назначавшаяся ранее при всех вариантах ИЗЛ иммуносупрессивная терапия оказалась неоправданной при многих заболеваниях. Действительно, при хроническом гиперсенситивном пневмоните, фибротическом варианте неспецифической интерстициальной пневмонии (в том числе в рамках системных заболеваний соединительной ткани), продвинутых стадиях легочного саркоидоза применение преднизолона и иммуносупрессивных препаратов не приводит к торможению фиброзного ремоделирования легочной ткани и значительно повышает риск респираторных инфекций и других нежелательных явлений [1].
М.Ю. Бровко. В начале XXI века для лечения идиопатического легочного фиброза, характеризующегося рентгенологической и гистологической картиной обычной интерстициальной пневмонии, были зарегистрированы два препарата с доказанным антифиброзным действием – нинтеданиб и пирфенидон [2,3]. Общность механизмов развития легочного фиброза при обычной интерстициальной пневмонии и других вариантах фиброзирующих ИЗЛ позволили предположить, что эти препараты могут найти применение и при других заболевания [4].
Нинтеданиб является низкомолекулярным ингибитором тирозинкиназ, блокирующим важнейшие сигнальные пути фиброгенеза в легочной ткани, в которых участвуют фактор роста тромбоцитов (PDGF), фактор роста эндотелия сосудов (VEGF) и фактор роста фибробластов (FGF) [5]. Первоначально этот препарат изучали при онкологических заболеваниях и применяли для лечения немелкоклеточного рака легкого, однако в 2014 году были завершены 52-недельные двойные слепые плацебоконтролируемые исследования INPULSIS-1 и INPULSIS-2, которые доказали способность препарата замедлять прогрессирование идиопатического легочного фиброза [2]. В целом в эти исследования были включены 1066 пациентов с идиопатическим легочным фиброзом, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день или плацебо. Первичной конечной точкой была ежегодная скорость снижения форсированной жизненной емкости легких (ФЖЕЛ). В обоих исследованиях в группе нинтеданиба она была примерно в два раза ниже, чем в группе плацебо (в исследовании INPULSIS-1 разница ежегодной скорости снижения ФЖЕЛ между группами составила 125,3 мл; p 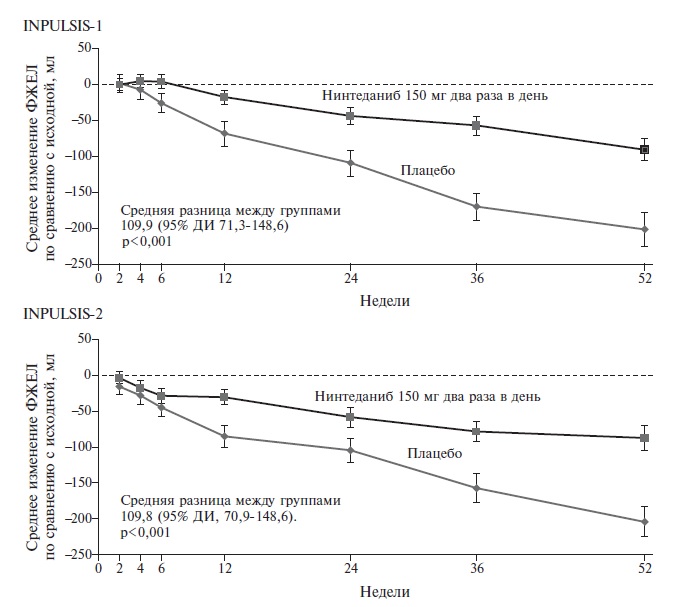
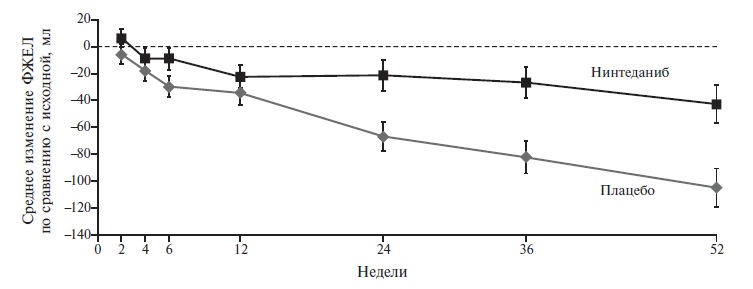
В 2018 г. после завершения двойного слепого, плацебо-контролируемого исследования SENCSIS была подтверждена эффективность назначения нинтеданиба при прогрессирующем поражении легких в рамках системной склеродермии (ССД) [6]. В исследование были включены 576 больных, которых рандомизировали на группы нинтеданиба в дозе 150 мг два раза в день внутрь или плацебо. Первичная конечная точка была такой же, как в исследованиях INPULSIS. Лечение нинтеданибом достоверно задерживало развитие фиброза у больных ССД, а разница ежегодной скорости снижения ФЖЕЛ между двумя группами составила 41,0 мл в пользу нинтеданиба (р=0,04; рис. 2).
П.И. Новиков. ССД – это аутоиммунное заболевание, в основе которого лежат генерализованная микроангиопатия и активация процессов фиброгенеза. На ранних стадиях заболевание проявляется кожными изменениями в виде плотного отека пальцев и синдромом Рейно, которые могут не сопровождаться ухудшением общего состояния или признаками поражения внутренних органов (в том числе одышкой), поэтому пациенты зачастую не сразу обращаются за медицинской помощью. В связи с этим ССД нередко диагностируют поздно, когда патологические изменения в органах необратимы, а лечение менее эффективно. По данным канадского регистра, у 408 пациентов диагноз ССД был установлен в среднем через 6,0 лет после развития феномена Рейно и через 2,7 года после появления первых «внекожных» проявлений [7]. В России ССД диагностировали через 2,0–2,7 года после появления феномена Рейно при диффузной форме заболевания [8]. При этом результаты крупного исследования (n=5860) показали, что смертность пациентов с ССД достигает 68 на 1000 человек в год [9]. Таким образом, своевременная диагностика ССД представляет собой сложную, но очень важную задачу для врача. Примерно у 75% больных уже в первые годы заболевания выяв ляют интерстициальное поражение легких, характеризующееся медленным прогрессирующим течением с исходом в фиброз разной степени тяжести [10]. Л.В. Теплова и соавт. с помощью компьютерной томографии высокого разрешения выявили признаки поражения интерстиция легких у 82% из 138 пациентов с ССД [11].
Лечение ИЗЛ в рамках ССД обычно начинают с иммуносупрессивных препаратов, в частности циклофосфамида [12]. В многоцентровом, проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании лечение цифлофосфамидом внутривенно в течение 6 мес с последующей заменой на азатиоприн привело к увеличению ФЖЕЛ на 4,2% по сравнению с контролем [13], что указывало на способность препарата замедлять прогрессирование поражения легких при этом заболевании. Тем не менее, через 2 года после начала 12-месячной иммуносупрессивной терапии было выявлено ухудшение ФЖЕЛ и рентгенологической картины [14].
В рандомизированном, двойном слепом 24-месячном исследовании микофенолат мофетил в дозе 3000 мг/сут у больных ССД с поражением легких не отличался от циклофосфамида в дозе 2 мг/кг/сут внутрь по эффективности, но имел преимущества по переносимости [15]. Результаты небольших неконтролируемых исследований свидетельствуют о том, что ритуксимаб может улучшить течение ИЗЛ у больных ССД [16]. Недавно эффективность и безопасность ритуксимаба были изучены у 254 больных ССД (у 58% из них имелось ИЗЛ), получавших лечение в центрах, которые входят в программу EUSTAR (в Российской Федерации – НИИ ревматологии им. В.А. Насоновой и клиника им. Е.М. Тареева). Контрольную группу составили 9575 подобранных пациентов с ССД, которым проводилось лечение другими препаратами. Хотя ритуксимаб вызывал улучшение фиброза кожи, он не оказывал существенного влияния на динамику ФЖЕЛ или диффузионной способности по оксиду углерода (DLCO).
В целом приведенные данные свидетельствуют о том, что иммуносупрессивные препараты, в том числе циклофосфамид, микофенолат мофетил и ритуксимаб, позволяют стабилизировать течение ИЗЛ у части, но далеко не у всех больных ССД, что определяет необходимость применения других подходов к лечению, прежде всего с использованием препаратов, обладающих антифиброзной активностью.
С.В. Моисеев. Особенно трудным является ведение пациентов с поражением легких в рамках ССД, у которых легочный фиброз прогрессирует несмотря на адекватную иммуносупрессивную терапию. Приводим клиническое наблюдение:
Л.А. Акулкина. Пациентка А., 50 лет. С 35 лет отмечает онемение и посинение пальцев рук на холоде. Диагностирован синдром Рейно. В 2010 г. в возрасте 40 лет появились малопродуктивный кашель и одышка при физической нагрузке. По месту жительства респираторная симптоматика трактовалась как проявление инфекционного процесса, в связи с чем периодически проводились антибактериальная терапия, инфузии эуфиллина без существенного эффекта. В 2014 г. при мультиспиральной компьютерной томография органов грудной клетки (МСКТ) выявлены признаки интерстициальной пневмонии, однако какая-либо терапия назначена не была, а дыхательная недостаточность постепенно нарастала. При контрольной МСКТ через полтора года в обоих легких, преимущественно в нижних долях, определялись участки фиброза и «сотового легкого» на фоне значительных интерстициальных изменений по типу «матового стекла» с утолщением и уплотнением легочного интерстиция и междольковых перегородок (более выражено в периферических отделах), а также внутригрудная лимфаденопатия верхней паравазальной, ретрокавальной, трахеобронхиальных и бифуркационной групп до 13 мм. Обратилась к фтизиатру, который исключил туберкулез органов дыхания. В 2016 г. в возрасте 46 лет впервые госпитализирована в клинику им. Е.М. Тареева. При осмотре обращали на себя внимание изменения кожи с формированием «кисетного рта», плотный отек пальцев рук, синдром Рейно с дигитальными язвами. При обследовании выявлены антинуклеарный фактор (АНФ) в титре 1:1280, положительные антитела к цитоплазматическому антигену SS-A (Ro), резкоположительные антитела к топоизомеразе I Scl-70. ФЖЕЛ была снижена до 74%, а DLСО – до 58%. При эхокардиографии выявлены умеренные признаки легочной гипертензии с повышением систолического давления в легочной артерии до 45 мм рт. ст. Сочетание характерных кожных изменений, синдрома Рейно, изменений в легких по типу прогрессирующего фиброзирующего заболевания легких (утолщение, деформация внутридолькового и междолькового легочного интерстиция, участки кистозной трансформации легочной ткани, уменьшение нижних долей легких в размерах, наличие тракционных бронхоэктазов, уплотнение легочной ткани по типу «матового стекла» в субплевральных и базальных отделах обоих легких) и серологических маркеров позволило диагностировать ССД с поражением легких. Начата комбинированная иммуносупрессивная терапия циклофосфамидом в дозе 800 мг внутривенно ежемесячно в течение 5 месяцев, пероральный прием преднизолона 10 мг/сут и гидроксихлорохина 200 мг/сут. В результате терапии отмечены уменьшение одышки и кашля, повышение толерантности к физическим нагрузкам, однако каждая инфузия циклофосфамида сопровождалась инфекционными осложнениями. Тем не менее, при МСКТ через 6 мес наблюдалась умеренная отрицательная динамика в виде нарастания интерстициальных фиброзных изменений в легких. Циклофосфамид был заменен на микофенолат мофетил, а терапия преднизолоном продолжена в прежней дозе. Увеличить дозу микофенолата мофетила до целевой не удалось в связи с развитием стойкой диареи, поэтому препарат был отменен. В декабре 2016 г. начаты инфузии ритуксимаба. В результате лечения наблюдался некоторый положительный клинический эффект в виде уменьшения одышки и выраженности синдрома Рейно, повышения толерантности к физическим нагрузкам. В мае 2017 г. лабораторные признаки активности заболевания отсутствовали, а при МСКТ выявлено уменьшение выраженности изменений по типу «матового стекла» в обоих легких, однако площадь фиброзных изменений несколько увеличилась. С учетом полной деплеции CD19+ B-лимфоцитов в периферической крови повторное введение ритуксимаба было решено отложить. В апреле 2018 г. рентгенологическая картина и функциональные легочные показатели без динамики. Отмечено нарастание числа CD19+ В-лимфоцитов до 0,8%, в связи с чем проведена очередная инфузия ритуксимаба 1 г. В мае 2019 года функция легких оставалась относительной стабильной (ФЖЕЛ 67%, DLCO 46%), однако при МСКТ отмечено нарастание уплотнения легочной ткани по типу «матового стекла». Выполнено очередное введение ритуксимаба 1 г. При обследовании в декабре того же года клиническое состояние пациентки стабильно, признаков активности ССД нет, однако выявлено нарастание фиброзных изменений легочной ткани при отсутствии существенной динамики ФЖЕЛ и DLCO. В настоящее время обсуждается возможность назначения нинтеданиба.
М.Ю. Бровко. История заболевания пациентки де монстрирует недостаточную эффективность применявшихся иммуносупрессивных лекарственных препаратов – несмотря на лечение в течение 3 лет отмечено снижение показателей легочной вентиляции, в том числе ФЖЕЛ на 10% и DLCO на 12%. В этом случае оправдано применение антифибротической терапии, так как в исследовании SENCSIS лечение нинтеданибом у таких больных позволило замедлить нарастание респираторного дефицита у пациентов с ССД практически вдвое [6].
В.И. Шоломова. Опубликованные в 2019 г. результаты 52-недельного двойного слепого, плацебо-контролируемого исследования INBUILD подтвердили эффективность терапии нинтеданибом при практически полном спектре фиброзирующих ИЗЛ, не относящихся к ИЛФ. В исследовании приняли участие 663 пациента из 15 стран, включая Российскую Федерацию. Критериями включения были признаки интерстициального фиброза с вовлечением более 10% легочной паренхимы по данным МСКТ органов грудной клетки в сочетании с признаками прогрессирования заболевания за предыдущие 24 мес (нарастание рентгенологических изменений, снижение ФЖЕЛ, усугубление респираторной симптоматики) несмотря на иммуносупрессивную терапию. Лечение нинтеданибом 150 мг два раза в сутки и плацебо получали пациенты с гиперсенситивным пневмонитом, идиопатической неспецифической интерстициальной пневмонией, неклассифицируемой интерстициальной пневмонией, поражениями легких, ассоциированными с различными системными заболеваниями соединительной ткани (в том числе ССД, ревматоидным артритом), профессиональными заболеваниями и саркоидозом. У большей части пациентов (62,1%) имелись рентгенологические изменения, соответствующие паттерну обычной интерстициальной пнев монии.
В группе нинтеданиба отмечено значительное снижение ежегодной скорости падения ФЖЕЛ – 80,8 мл/год против 187,8 мл/год в группе плацебо (различие между группами составило 107 мл/год, р 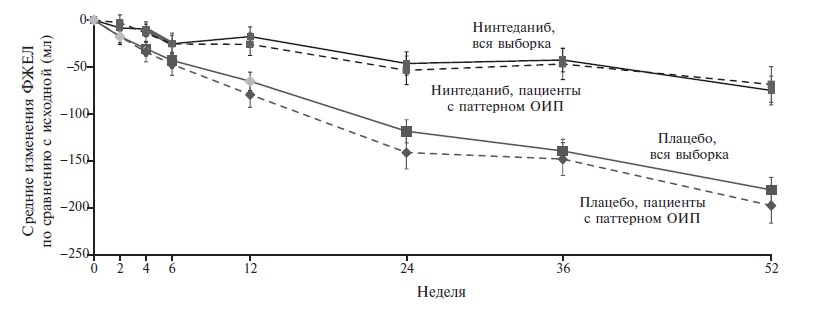
А.Ш. Янакаева. Больная К., 65 лет. В 2014 г. в возрасте 60 лет появился постоянный сухой кашель, однако к врачу не обращалась. В январе 2016 г. при диспансеризации впервые выявлены патологические признаки на рентгенограммах легких. При МСКТ обнаружены изменения по типу «матового стекла» в базальных отделах обоих легких, увеличение внутригрудных лимфатических узлов до 14 мм. Признаков дыхательной недостаточности не выявлено. ФЖЕЛ составила 110%, однако исследование диффузионной способности не проводилось. При эхокардиографии без существенных отклонений. Диагностирована идиопатическая интерстициальная пневмония. Проводилась терапия преднизолоном 25 мг/сут и ацетилцистеином 600 мг/сут. При контрольной МСКТ через 6 мес положительной динамики не наблюдалось, сохранялся сухой кашель. Рекомендовано продолжить прием преднизолона в дозе 15 мг/сут.
В апреле 2017 г. госпитализирована в Клинику им. Е.М. Тареева с жалобами на мучительный сухой кашель, слабость, умеренную одышку. В базальных отделах обоих легких выслушивалась крепитация. ФЖЕЛ – 91%, DLСО – 67%. Рентгенологически определялась картина неспецифической интерстициальной пневмонии. По сравнению с предыдущим исследованием отмечено нарастание фиброзных изменений, в то время как выраженность зон «матового стекла» существенно не изменилась (рис. 4). При иммунологическом исследовании обнаружено повышение титра АНФ до 1:320, слабоположительный титр SS-A. Неоднократно осматривалась ревматологом, данных за какое-либо системное заболевание соединительной ткани не было. Диагностирована интерстициальная пневмония с аутоиммунными признаками [18]. Продолжена терапия преднизолоном в дозе 20 мг/сут, к которому был добавлен микофенолат мофетил в дозе 2000 мг/сут. В ноябре 2017 г. отмечено уменьшение площади интерстициальных изменений по типу «матового стекла» при усилении выраженности тракционных бронхоэктазов. Несмотря на проводимую иммуносупресивную терапию вентиляционная функция продолжала снижаться, в том числе ФЖЕЛ до 82% и DLСО до 61%. С учетом неэффективности иммуносупрессивной терапии и соответствия пациенки критериям отбора в исследование INBUILD в декабре 2017 г. начато лечение нинтеданибом в дозе 150 мг два раза в сутки в сочетании с преднизолоном в дозе 10 мг/сут. На фоне 2-летней терапии нинтеданибом впервые отмечена стабилизация показателей функции внешнего дыхания: в сентябре 2019 г. ФЖЕЛ составила 81%, а DLСО – 59%. При МСКТ выраженность фиброзных изменений не изменилась, в связи с чем терапию антифиброзным препаратом решено продолжить.
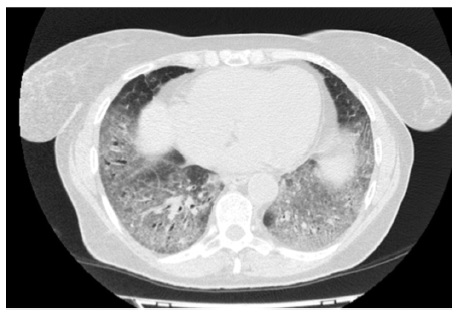
С.В. Моисеев. Представленные истории болезни демонстрируют варианты неблагоприятного фиброзирующего течения ИЗЛ, отличных от идиопатического легочного фиброза. Обеим пациенткам показана длительная терапия антифиброзным лекарственным препаратом – нинтеданибом в дозе 150 мг два раза в сутки. Результаты плацебо-контролируемых клинических исследований свидетельствуют о том, что лечение этим препаратом оказывает благоприятное влияние на различные фиброзирующие заболевания легких. Очевидно, что лучших результаты терапии можно ожидать у второй пациентки, учитывая отсутствие системного заболевания. Однако и первой больной назначение нинтеданиба также показано, так как неблагоприятный прогноз в первую очередь определяется поражением легких и прогрессирующей дыхательной недостаточности.
Необходимость лечения нинтеданибом должна быть подтверждена в лечебном учреждении, занимающемся изучением ИЗЛ и имеющем опыт ведения таких пациентов. Нинтеданиб переносится удовлетворительно и обычно не вызывает тяжелые нежелательные реакции, поэтому препарат может применяться под наблюдением врача поликлиники. Био химические показатели целесообразно контролировать ежемесячно в течение первых трех месяцев после начала лечения, а затем ежеквартально.
Источник
