Гистологический препарат печени крысы
У крыс после введения внутрибрюшинно CCl4 (100 мкг/кг) через 24 часа развивался выраженный гепатит. Отмечено снижение активности синтеза оксида азота в эндотелиальных и гладкомышечных клетках кровеносных сосудов [8]. Острое отравление тетрахлорметаном per os крыс в дозе 0,75 ЛД50 через 4 суток вызывало снижение основных гуморальных и клеточных иммунных реакций [2].
При хроническом токсическом гепатите крыс, вызванном введением 4-х хлористого углерода, наблюдалось увеличение паракортикальной зоны в брыжеечных лимфатических узлах, что свидетельствует, по мнению авторов, об усилении иммунного ответа по гуморальному типу [7].
После трехкратного введения 50 % масляного раствора CCl4 через день крысам отмечено снижение в печени нуклеиновых кислот на 16 % и общего белка на 18 % по сравнению с показателями интактных животных [4].
Хроническая интоксикация животных тетрахлорметаном вызывала выраженные дистрофические и воспалительные изменения в печени и в регионарных лимфатических узлах. При беременности у самок и у потомства эти изменения сохранялись, но были выражены меньше. Авторы считают, что в этих условиях у животных лучше сохранялась дренажно-детоксикационная функция лимфатической системы [5]. Радиоиммунным методом установлено увеличение содержания ренина, ангиотензина I и II, альдестерона и активности ангиотензин-конвертирующего фермента при токсическом гепатите, вызванным введением CCl4 крысам [9].
В последние годы среди неинвазивных методов диагностики хронического гепатита и портальной гипертензии важное место отводится ультразвуковым исследованиям [7, 1].
Материалы и методы исследования
Эксперименты проведены на 102 половозрелых белых лабораторных крысах-самцах линии Вистар, массой 180-250 гр. Для создания модели токсического гепатита использовали 50 % масляный раствор четыреххлористого углерода (CCl4), который вводился внутрибрюшинно (0,3 мг/кг) один раз в течение 3 суток через день. Наличие токсического гепатита у крыс было подтверждено гистологическими и биохимическими исследованиями.
Острые опыты проводились на 2 группах крыс: 1-я группа крыс – контрольная (24 интактных крыс) и 2-я группа – это крысы с моделью токсического гепатита (78 крыс) с соблюдением основных принципов Хельсинской конвенции о гуманном отношении к лабораторным животным. Через 15 суток после интоксикации крыс 4-х хлористым углеродом под эфирным наркозом прижизненно регистрировали лимфоток из грудного и кишечного лимфатического сосуда.
Морфологический состав крови у крыс с токсическим гепатитом изучали на гематологическом анализаторе SYSMEXKX-219 (Япония). Время свертывания крови и лимфы определяли по Сухареву, вязкость – на вискозиметре ВК-4, рН – на анализаторе OSMETECHOPTITMССА (США).
Определение морфологического состава лимфы проводили в камере Горяева с сеткой Бюркера. Определяли число лейкоцитов, лейкоцитарную формулу – в сухих мазках лимфы, окрашенных по методу С.П. Романовского. Для изучения гистологических препаратов использовали световой микроскоп Leica – DМ-1000.
Изучался уровень кровоснабжения в печени, в частности, в разных долях печени: правой и левой методом импендансной реографии на реографе «Рео-Мицар» (Россия).
В наших опытах определялась объемная скорость кровотока в магистральных сосудах брюшной полости: в печеночной артерии, в воротной вене, в селезеночной артерии и вене, нижней полой вене на ультразвуковом лазерном приборе Допплера «Сономед-300» (Россия). Комплексное ультразвуковое исследование кровенаполнения сосудов выполнялось на наркотизированных крысах строго натощак с конвексным датчиком частотой 8 МГц [20, 21]. Линейная скорость кровотока определялась в основном стволе воротной вены на уровне ворот печени при сканировании через межреберья.Расчет кровотока производили в см/с. Каждое измерение проводили в течение не менее 10 минут.
Полученный материал обработан на компьютере вариационно-статистическим методом с использованием критерия Стьюдента.
Результаты исследования и их обсуждение
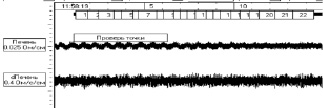
Результаты реогепатографического исследование у крыс контрольных группы представляли собой чередующие систолические волны достаточной амплитуды, с закругленной вершиной и диастолическим подъемом. Скорость быстрого кровенаполнения составляла в контроле 1,02 ± 0,06 Ом/с, скорость медленного кровенаполнения 0,15 ± 0,02 Ом/с. На фоне токсического гепатита наблюдали, что форма кривой характеризовалась появлением заостренной и зазубренной, а в некоторых случаях платообразной вершины.
Результаты исследований на крысах с токсическим гепатитом показали противоречивые данные, в одних случаях наблюдали увеличение амплитуды систолической волны на 65 %.Скорость быстрого кровенаполнения составляла 6,06 ± 0,5 Ом/с, а медленного кровенаполнения – 4,05 ± 0,02 Ом/с. В других случаях наблюдали уменьшение амплитуды диастолической и систолической волны на 45 %, с одновременным уменьшением скорости быстрого кровенаполнения до 0,70 ± 0,02 Ом/с, но возрастала скорость медленного кровенаполнения (рисунок).
а) реогепатограмма контрольной группыу крыс
б) реогепатограмма на фоне токсического гепатита у крыс
Кривая реогепатограммы у крыс с контрольной группой и на фоне токсического гепатита
По мнению некоторых авторов, изменение кривой реогепатограммы происходит разнонаправлено, но, в основном, зависит от этиологии заболеваниях [9]. При вирусной этиологии происходит снижение амплитуды систолической волны, при токсическом гепатите происходит обратный эффект т.е. идет увеличение амплитуды систолической волны.
Изучение скорости кровотока методом лазерной ультразвуковой доплерографии у крыс на фоне хронической затравки СCl4 показало, что скорость линейного кровотока в воротной вене снижалась, а в печеночной артерии скорость кровотока повышалась по сравнению с контрольной группой. Пульсационный индекс и индекс периферического сопротивления уменьшались в воротной вене и в печеночной артерии на 25 % .Изменение этих показателей указывает на наличие нарушения гемодинамики печени на фоне токсического гепатита у крыс и начальным формированием проявлений портальной гипертензии (таблица).
Параметры кровотока в сосудах портальной системы
Источник
Гистологический препарат печени крысы
Зависимость большинства процессов жизнедеятельности организма от температуры окружающей среды делает температурные воздействия важнейшим фактором экологии, который может иметь решающее значение для выживания человека. С воздействием низких и сверхнизких температур человеку часто приходится встречаться при работе на различных производствах, а также в силу проживания – в некоторых климатических зонах. При этом пребывание организма в условиях гипотермического воздействия может приводить к значительным метаболическим и функциональным изменениям.
В условиях гипотермии печень как орган, вносящий значительный вклад в термопродукцию, играет очень важную роль [1–3]. За счет сложных биохимических реакций этот орган способен обеспечивать приспособляемость организма к сложным условиям существования. Печень обеспечивает пластические и энергетические процессы, а также регулирует адаптивные компенсаторно-приспособительные процессы, происходящие при воздействии всех экзогенных и эндогенных неблагоприятных процессов, и эта регуляция осуществляется даже тогда, когда повреждающие факторы не обладают выраженным гепатотропным эффектом [4]. Поэтому морфофункциональное состояние печени является отражением не только функционального состояния самого органа, но и реакции организма в целом.
Морфологические изменения органов человека и животных при воздействии неблагоприятных экзогенных факторов широко изучаются в последние годы [5–7]. Однако гистоструктура печени при воздействии гипотермии исследована лишь в ряде работ [8, 9], полученные данные противоречивы. Это касается, в частности, особенностей реакций гепатоцитов на холодовой фактор, характеристики числа двуядерных гепатоцитов и реакции ядер клеток печени в целом [10, 11].
Таким образом, сведения о влиянии гипотермии на гистоструктуру печени немногочисленны, а вопросы морфологии клеточного ядра гепатоцитов освещены недостаточно, поэтому необходимо проведение более детального изучения динамики морфологических изменений, происходящих в ядрах гепатоцитов при действии холодового фактора.
Цель исследования: проанализировать динамику патоморфологических изменений состояния ядер клеток печени крыс породы Вистар после воздействия однократной глубокой иммерсионной гипотермии.
Материалы и методы исследования
Исследование было проведено на 15 самцах крыс линии Вистар массой 200–250 граммов. Животных (n = 10) подвергали однократной глубокой водной (иммерсионной) гипотермии, которую моделировали помещением экспериментальных животных в индивидуальных клетках в воду температурой 5°С при температуре окружающей среды 7°С. Когда животные достигали глубокой степени гипотермии, воздействие холодового фактора прекращали. Критерием достижения глубокой степени гипотермии являлась ректальная температура 20–25°С. Время воздействия холодового фактора в среднем составляло 40±5 мин. Непосредственно сразу после прекращения охлаждения животные выводились из эксперимента декапитацией. Контрольную группу составляли 5 крыс, которых в индивидуальных клетках помещали в воду температурой 30°С при температуре окружающей среды 22–25°С.
Для гистологического исследования кусочки ткани печени фиксировали в течение 24 часов в 10%-ном растворе нейтрального формалина, после проводили обработку препаратов в автомате TISSUE-TEK VIPTM6 (Sakkura, Nagano Japan) с последующей заливкой в парафин в станции парафиновой заливки TISSUE-TEK TEC 5 (Sakkura, Nagano, Japan). На роторном микротоме Accu-Cut SRM (Sakkura, Китай) изготавливали срезы толщиной 5–7 мкм. В автостейнере TISSUE-TEK Prisma (Sakkura, Nagano, Japan) препараты окрашивали гематоксилин-эозином.
Для определения плоидности ядер гепатоцитов препараты окрашивали методом Фельгена с использованием холодного гидролиза в 1н. HCl в течение 1 часа 30 минут. Среднее содержание ДНК в ядре малого лимфоцита принимали за диплоидное значение (2с). Плодометрические измерения осуществляли в сертифицированной морфометрической программе ВидиоТест-Морфология 5.2. («ВидиоТест», Санкт-Петербург) с помощью специализированных модулей «Стандарт» и «Плоидность». Строили гистограммы распределения гепатоцитов по индексу накопления ДНК (ИНДНК) в ядре.
Для выявления гетерохроматина гистологические срезы окрашивали в 2%-ном растворе орсеина на 45%-ном растворе уксусной кислоты в течение 30 минут. Затем препараты фотографировали при помощи микроскопа Leica DM 750 E200 (Германия) с цифровой видеокамерой Leica EC3 (Германия) при увеличении х1000. Определяли среднее количество гранул гетерохроматина на 1 ядро, их локализацию и высчитывали содержание доли гетерохроматина от общей площади ядра клетки. Исследовали не менее 25–30 ядер клеток.
Окрашивание ядрышковых организаторов (AgNOR) проводили по двухступенчатому методу Daskal Y. et al. в нашей модификации [12]. Под масляной иммерсией микроскопа при увеличении х1000 высчитывали число ядрышек, площадь одного ядрышкового организатора и ядерно-ядрышковое соотношение в относительных единицах (отн. ед.).
Статистическую обработку полученных данных проводили с помощью пакета статистических программ Statistica 10.0. и пакета статистического анализа программы MS EXСEL 2010. Для каждой из полученных величин высчитывали среднее (M) и ошибку среднего (m). Гипотеза о нормальности распределения вероятности данных проверялась с помощью критерия Шапиро–Уилка. Достоверность данных оценивалась с помощью параметрического критерия t-теста Стьюдента. Критическое значение уровня статистической значимости было равно 0,05.
Результаты исследования и их обсуждение
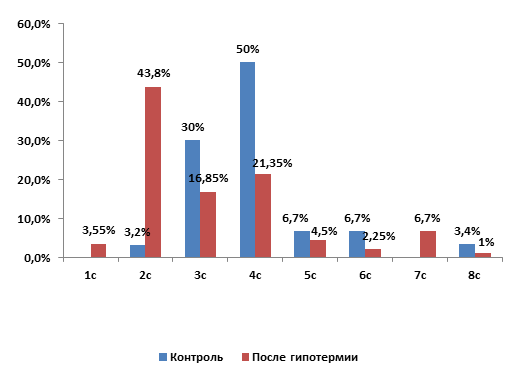
Контрольная группа. Морфологический анализ структуры ядер клеток печени животных контрольной группы позволил выявить следующее. Большинство гепатоцитов было одноядерными (79±1,5%), процент содержания двуядерных клеток составил 21±1,5%. При плоидометрическом исследовании ядер ИНДНК в среднем составил 3,9с±0,2. Ядра были представлены шестью уровнями плоидности: клонов клеток с ИНДНК 2с было 3,2%, 3с – 30%; 4c – 50%; 5c – 6,7%; 6c – 6,7% и 8с – 3,4% (табл.) (рис. 1).
Рис. 1. Гистограмма, характеризующая ИНДНК в группе контроля и при гипотермии.
По оси абсцисс – ИНДНК; по оси ординат – процентное содержание клеток
Морфометрические и морфофункциональные параметры ядер гепатоцитов при гипотермии в сравнении с группой контроля (М±m)
Источник
Гистологический препарат печени крысы
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
БУЗОО «Областная клиническая больница», Омск, Россия
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
Особенности регенерации оставшейся части печени крыс в ранние сроки после ее предельно допустимой резекции
Журнал: Оперативная хирургия и клиническая анатомия. 2018;2(3): 9-13
Храмых Т. П., Ермолаев П. А., Барская Л. О. Особенности регенерации оставшейся части печени крыс в ранние сроки после ее предельно допустимой резекции. Оперативная хирургия и клиническая анатомия. 2018;2(3):9-13.
Khramykh T P, Ermolaev P A, Barskaya L O. Features of regeneration of the rat remnant liver in the early periods after its maximum permissible resection. Russian Journal of Operative Surgery and Clinical Anatomy. 2018;2(3):9-13.
https://doi.org/10.17116/operhirurg201820319
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия


Цель исследования. Выявить в эксперименте особенности регенерации оставшейся части печени крыс в ранние сроки после ее предельно допустимой резекции. Материал и методы. Беспородным половозрелым белым крысам-самцам (п=60) проводили атипичную резекцию 80% печени оригинальным способом. Через 6 и 12 ч, 1, 3 и 7 сут после операции забирали остаток печени для гистологического исследования с окраской срезов гематоксилином и эозином. Результаты. Выявлено, что через 6 и 12 ч после резекции ведущими морфологическими признаками являлись острые дисциркуляторные расстройства паренхимы, в 1-е и 3-и сутки — дистрофия гепатоцитов с отдельными очагами некроза, на 7-е сутки — признаки регенераторных изменений гепатоцитов по типу гипертрофии. Заключение. Полученные данные свидетельствуют о регенераторных возможностях печени половозрелых крыс после ее предельно допустимой резекции по типу гипертрофии паренхимы, признаки которой выявлялись на 7-е сутки послеоперационного периода.
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
БУЗОО «Областная клиническая больница», Омск, Россия
ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск, Россия
В настоящее время обширные резекции печени являются «золотым стандартом» лечения пациентов с очаговыми образованиями печени — злокачественными опухолями, метастазами колоректального рака и раком внепеченочных желчных протоков. Резекции печени в наибольшей степени отвечают принципам хирургической онкологии и позволяют добиться высокой отдаленной выживаемости пациентов, а в ряде случаев их радикального излечения [1—4]. Основной причиной летальных исходов после массивных резекций печени является прогрессирующая печеночная недостаточность, связанная с удалением большого объема функционирующей паренхимы печени [5, 6]. В литературе достаточно широко освещена высокая способность печени к регенерации при различных патологических процессах [7, 8]. Однако закономерности регенераторных процессов после расширенных и предельно допустимых по объему резекций печени остаются малоизученными. Выяснение особенностей структурно-функциональной перестройки паренхимы печени после ее обширной резекции представляется актуальным в свете оценки резервных возможностей остатка органа обеспечивать гомеостаз и разработки эффективных мер профилактики и коррекции печеночной недостаточности.
Цель исследования — выявить в эксперименте особенности регенерации оставшейся части печени крыс в ранние сроки после ее предельно допустимой резекции.
Эксперименты были проведены на 60 беспородных половозрелых белых крысах-самцах массой 220—250 г c соблюдением Европейской конвенции по защите позвоночных животных. Рассчитывали объем выборки по формуле F. Lopez-Jimenez и соавт. [9]. Минимальное достаточное количество животных в группе составило 8 крыс.
Крыс наркотизировали диэтиловым эфиром (ОАО «Медхимпром») и выполняли оригинальную атипичную предельно допустимую по объему резекцию левой и срединной долей печени, что составляло 80% от массы этого органа и было эквивалентно объему данной резекции печени у человека [10]. Схема оперативного вмешательства представлена на рис. 1 и 

Через 6 и 12 ч, 1, 3 и 7 сут (n=12) после операции забирали остаток печени для гистологического исследования с фиксацией 10% нейтральным формалином, заливкой в парафин и последующей окраской срезов гематоксилином и эозином.
Результаты обработаны с применением программы Statistica 6,0. Достоверность различий полученных показателей определяли с использованием непараметрического критерия Манна—Уитни. За критический уровень было принято p 
В гистологических препаратах оставшейся после резекции печени, взятой в 1-е и 3-и сутки послеоперационного периода, уменьшалась выраженность признаков дисциркуляторных нарушений, а именно полнокровия и сладж-феномена, наблюдавшихся практически сразу после операции, что может быть связано с оптимизацией функции портокавальных анастомозов. В то же время уже отмечались признаки повреждения гепатоцитов — дистрофия с отдельными очагами некроза. При этом было обнаружено 2 вида дистрофии гепатоцитов — жировая (средне- и крупнокапельная) и вакуольная (гидропическая) (см. рис. 3, б). В препарате очаги некроза печеночной ткани представлены мелкими интралобулярными участками мононуклеарной инфильтрации на месте погибших гепатоцитов (см. рис. 3, б). Кроме того, были обнаружены преднекротические (некробиотические) изменения, визуализирующиеся в виде конденсации хроматина и деформации ядер (кариопикноз).
В препаратах оставшейся части печени, взятой на 7-е сутки послеоперационного периода, на первый план выступили изменения в краевой зоне резекции, которые были обусловлены реакцией организма, в частности самой печени, на операционную травму. Непосредственный край резекции ярко представлен некротическим детритом, представляющим собой гомогенную безъядерную эозинофильную массу с участками сохраненной отчетливой органоидной структуры (так называемое балочное строение) (рис. 4, а). 
По данным литературы, способность печени к регенерации зависит от объема резекции. Так, при резекции менее 30% печени регенерация имеет низкие темпы, при резекции 40—70% печени наблюдается прямая зависимость между объемом резекции, интенсивностью синтеза ДНК и уровнем пролиферативной активности гепатоцитов [11, 12].
Классической моделью для изучения регенерации печени новорожденных крыс является резекция 70% печени по методу G. Higgins и R. Anderson. Регенерация печени у крыс после резекции такого объема происходит за счет пролиферации гепатоцитов [13].
Альтернативным способом восстановления массы печени после резекции является увеличение размеров гепатоцитов — гипертрофия клеток без увеличения плоидности ядра, особенно в условиях блокады митоза по каким-либо причинам [14]. При превышении предельно допустимого объема резекции (в условиях удаления более 85% печени) наблюдается десинхронизация вступления клеток в митоз. Возможность регенерации за счет гипертрофии клеток также значительно угнетена, что в конечном итоге приводит к летальному исходу вследствие прогрессирующей печеночной и в целом полиорганной недостаточности [11, 12, 15].
Полиплоидия как компонент регенерации печени является вариантом пролиферации, при котором митотический цикл осуществляется не до конца. В настоящее время предполагают, что полиплоидизация — это реакция органа на повышенную функциональную нагрузку, что является механизмом защиты генома клетки от окислительного стресса [8, 16].
Анализируя данные литературы и полученные в ходе исследования результаты, мы пришли к заключению о том, что 80% резекция печени является предельно допустимой по объему. При ней еще возможны процессы регенерации остатка печени в виде гипертрофии паренхимы, морфологические признаки которой выявлялись на 7-е сутки послеоперационного периода в отсутствие признаков гиперплазии органа. Однако регенерация паренхимы в условиях такой резекции является функционально неполноценной, что подтверждается полученными нами ранее данными об истощении антиоксидантной системы и нарушении детоксикационной функции 20% остатка печени в эти же сроки послеоперационного периода [17]. Это позволяет предположить развитие срыва компенсаторных возможностей критического объема печени на фоне возросшей нагрузки и вторичного повреждения в условиях гипоксии смешанного генеза, окислительного стресса и системной эндотоксемии [17, 18] с закономерным формированием мелкоочагового фиброза и в последующем цирроза печени.
В паренхиме печени крыс, оставшейся после 80% резекции, на 7-е сутки после операции были выявлены следующие морфологические признаки регенерации: увеличение размеров гепатоцитов в 1,2 раза по сравнению с предыдущими сроками послеоперационного периода, эозинофильная зернистость цитоплазмы, увеличение ядерно-цитоплазматического соотношения, гиперхромия ядер, значительное количество полиплоидных гепатоцитов. Полученные в ходе исследования морфологические данные свидетельствуют о регенераторных возможностях печени половозрелых крыс после ее предельно допустимой резекции по типу гипертрофии оставшейся паренхимы, направленной на компенсацию функций утраченной части органа.
В перспективе необходимо проведение дальнейших исследований по разработке патогенетически обоснованных путей гепатопротекции, коррекции печеночной недостаточности и предупреждения патологического ремоделирования оставшейся части печени в послеоперационном периоде для улучшения результатов ее обширных резекций у пациентов.
Авторы заявляют об отсутствии конфликта интересов.
Концепция и дизайн исследования — Т.П. Храмых
Сбор и обработка материала — П.А. Ермолаев, Л.О. Барская
Статистическая обработка — П.А. Ермолаев
Написание текста — П.А. Ермолаев, Т.П. Храмых
Источник