Ожирение и инсулинорезистентность: механизмы развития и пути коррекции
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
На сегодняшний день ожирение является одной из основных проблем здравоохранения. Патологии, ассоциированные с ожирением, такие как инсулинорезистентность, сахарный диабет 2 типа и сердечно-сосудистые заболевания, оказывают значительное влияние не только на здоровье пациента, но и, увеличивая бремя расходов на лечение этих патологий, на систему здравоохранения и общество в целом. Инсулинорезистентность является основным патогенетическим механизмом развития сахарного диабета 2 типа и ряда других заболеваний, поэтому крайне важно понимать патогенез развития данного состояния. В статье описываются основные факторы риска и механизмы развития инсулинорезистентности: молекулярные механизмы, воспаление, стресс эндоплазматического ретикулума, дисфункция митохондрий. Рассматриваются основные терапевтические стратегии коррекции этого состояния, в том числе применение новых классов препаратов. Накопление клинического опыта и данных дальнейших исследований поможет определить более точное место нового класса препаратов в алгоритмах лечения нарушений углеводного обмена.
Ключевые слова: сахарный диабет, ожирение, инсулинорезистентность, молекулярные механизмы, стресс эндоплазматического ретикулума, дисфункция митохондрий.
Для цитирования: Барсуков И.А., Демина А.А. Ожирение и инсулинорезистентность: механизмы развития и пути коррекции. РМЖ. 2021;2:26-30.
Obesity and insulin resistance: pathogenesis and ways of correction
I.A. Barsukov, A.A. Demina
M.F. Vladimirskiy Moscow Regional Research and Clinical Institute, Moscow
Obesity is currently one of the major healthcare problems. Pathologies associated with obesity (insulin resistance, type 2 diabetes mellitus and cardiovascular diseases) have a significant impact not only on the patient but also on the healthcare system and society as a whole. Insulin resistance is the main pathogenetic mechanism for the development of type 2 diabetes mellitus and many other diseases that significantly affect society. Thus, it is extremely important to understand this condition pathogenesis. The article describes the primary risk factors and mechanisms for the development of insulin resistance: molecular mechanisms, inflammation, endoplasmic reticulum stress, mitochondrial dysfunction. The article also considers the main therapeutic principles concerning correction of this condition, including new drug classes. The accumulation of clinical experience and further research data will help to determine a more precise place of the new drug class in the treatment algorithms for carbohydrate metab olism disorders.
Keywords: diabetes mellitus, obesity, insulin resistance, molecular mechanisms, endoplasmic reticulum stress, mitochondrial dysfunction.
For citation: Barsukov I.A., Demina A.A. Obesity and insulin resistance: pathogenesis and ways of correction. RMJ. 2021;2:26–30.
Эпидемиология ожирения
На сегодняшний день ожирение является одной из основных проблем здравоохранения. По данным Всемирной организации здравоохранения (ВОЗ), с 1975 г. количество людей, страдающих избыточным весом и ожирением, выросло более чем в 3 раза. Так, в 2016 г. более 1,9 млрд (39%) взрослых имели избыточный вес, а свыше 650 млн из них страдали ожирением. Более того, по оценкам ВОЗ, в 2016 г. около 41 млн детей в возрасте до 5 лет имели избыточный вес или ожирение [1].
Заболевания и состояния, ассоциированные с ожирением, такие как инсулинорезистентность (ИР), сахарный диабет (СД) 2 типа и болезни сердечно-сосудистой системы, оказывают значительное влияние не только на здоровье пациента, но и, увеличивая бремя расходов на лечение этих патологий, на систему здравоохранения и общество в целом. При этом почти 90% больных СД 2 типа имеют ожирение, которое признано важнейшим фактором риска развития диабета [2]. Риск заболеть СД 2 типа увеличивается в 2 раза при наличии ожирения 1-й степени, в 5 раз — при ожирении 2-й степени и более чем в 10 раз — при наличии тяжелой, 3-й степени ожирения [1]. Тем не менее, хотя негативное влияние ожирения на организм очевидно, метаболические и сердечно-сосудистые осложнения развиваются далеко не у всех [3].
Ожирение является одним из основных факторов риска развития ИР [4]. С учетом того, что ИР служит основным патогенетическим механизмом развития СД 2 типа и ряда других заболеваний, крайне важно понимать патогенез развития данного состояния. Для лучшего понимания необходимо рассмотреть основные механизмы действия инсулина на клетки-мишени.
Механизм действия инсулина
Инсулин является не только одним из основных гормонов, регулирующих обменные процессы, но и оказывает значительное опосредованное влияние на основные функции клеток и органов [5–7]. Его метаболическое действие на клетки печени, мышечной и жировой тканей до сих пор остается предметом множества крупных исследований, т. к. именно эти ткани ответственны за обмен веществ и накопление энергии. Более того, изменение их функций является основным патогенетическим звеном в развитии ИР, ожирения и СД 2 типа [8]. Основной вклад в регуляцию промежуточного метаболизма и утилизации нутриентов инсулин вносит в постпрандиальный период, когда повышение уровня глюкозы в крови стимулирует его секрецию [4]. Это, в свою очередь, стимулирует утилизацию глюкозы преимущественно скелетными мышцами (с образованием гликогена) и жировой тканью (с образованием триглицеридов) [4]. В печени инсулин подавляет глюконеогенез, гликогенолиз и кетогенез [8]. Инсулин также способствует сохранению мышечной массы путем ингибирования протеолиза, увеличения синтеза определенных белков [4] и повышению липогенеза в жировой ткани [9].
Кроме того, инсулин регулирует сократительную способность сердечной мышцы и сосудистый тонус [10, 11]. Через активацию эндотелиального фермента синтазы оксида азота (endothelial nitric oxide synthase, eNOS) он стимулирует выработку оксида азота (NO) в эндотелии [8]. Впоследствии NO диффундирует в просвет сосудов и сосудистые гладкомышечные клетки, активируя гуанилатциклазу, и, как следствие, увеличивает концентрацию циклического гуанозинмонофосфата, что приводит к расслаблению гладких мышц кровеносных сосудов. Усиленный таким образом кровоток приводит к увеличению утилизации глюкозы тканями-мишенями [10, 11].
На молекулярном уровне механизм действия инсулина опосредован взаимодействием с рецептором, принадлежащим к семейству с внутренней тирозинкиназной активностью. Он представляет собой интегральный мембранный гликопротеин, состоящий из двух α- и двух β-субъединиц. При связывании инсулина с α-субъединицей происходят конформационные изменения, которые стимулируют ее каталитическую активацию и аутофосфорилирование нескольких остатков тирозинкиназы, расположенных в цитозольной области β-субъединицы [12]. Затем аутофосфорилированные остатки распознаются рядом адапторных белков из семейства субстратов инсулина (Insulin receptor substrate, IRS), основными из которых являются IRS-1 и IRS-2. IRS запускает внутриклеточные сигнальные каскады и способствует образованию молекулярных комплексов [13].
Большинство эффектов инсулина обусловлены активацией двух основных сигнальных путей: фосфатидилинозитол-3-киназы (PI3K) /Akt (она же протеинкиназа В) и митогенактивированной протеинкиназы МАРК/RAS. Через PI3K/Akt реализуются большинство метаболических эффектов инсулина. Так, захват глюкозы периферическими тканями под действием инсулина происходит благодаря активации PI3K/Akt пути и транслокации глюкозного транспортера GLUT-4 из цитозоля в плазматическую мембрану с последующим трансмембранным переносом глюкозы в клетку. С помощью МАРК/RAS, второго сигнального пути, инсулин регулирует экспрессию генов и оказывает митогенные эффекты. В результате его активации усиливаются пролиферация гладкомышечных клеток, синтез коллагена, стимулируются рост и пролиферация эндотелиальных клеток (рис. 1) [14].
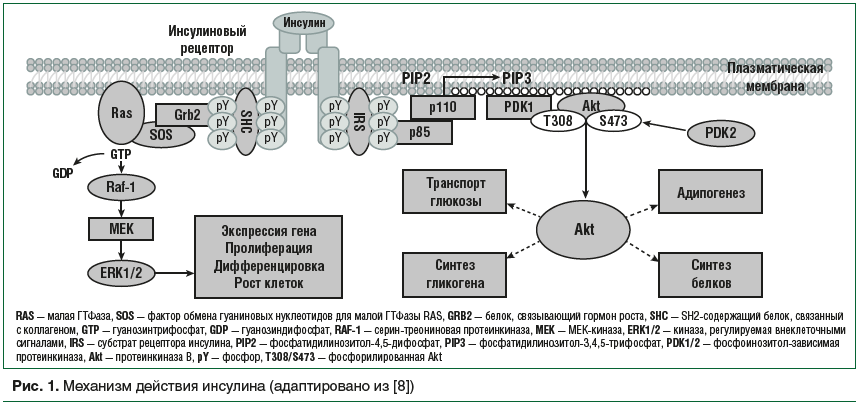
Таким образом, сложный процесс передачи сигнала от инсулина клетке происходит с участием многих ферментов и регуляторных белков. Любое нарушение их экспрессии и/или функций может нарушить нормальную передачу сигнала, тем самым приводя к ИР в периферических тканях [15, 16].
Основные механизмы развития ИР
ИР — это сложный патологический процесс, который характеризуется неадекватной реакцией инсулин-зависимых клеток на действие инсулина [15]. Несмотря на то, что любое нарушение действия инсулина может быть расценено как ИР, в клинической практике под этим термином чаще подразумевается снижение его влияния на метаболизм глюкозы [4]. Вместе с тем у пациентов c ИР и нарушением обмена глюкозы влияние инсулина на другие биологически важные мишени может быть сохранено или снижено в меньшей степени [16]. Стоит отметить, что наличие нарушений действия инсулина на мышечную и жировую ткани, а также скорость, с которой они развиваются при ИР, остаются предметом дискуссий и новых исследований [16, 17].
Молекулярные механизмы возникновения ИР
Одним из механизмов возникновения ИР является нарушение передачи сигнала от инсулина клетке. Оно может возникнуть на разных уровнях, включая мутации и/или посттрансляционные изменения в инсулиновом рецепторе, адапторных белках IRS или в других эффекторных молекулах. Чаще всего эти изменения вызывают снижение количества и каталитической активности рецепторов инсулина, а также усиление фосфорилирования белка IRS по остаткам серина, увеличение активности тирозиновой фосфатазы, снижение активности PI3K/Akt пути и нарушение экспрессии и активности GLUT-4 [8].
Усиление фосфорилирования белка IRS по остаткам серина является одним из существенных факторов, способствующих развитию ИР. Это приводит к снижению его фосфорилирования по остаткам тирозина и, как следствие, к нарушению связывания с PI3K, препятствуя таким образом проведению сигнала внутрь клетки по PI3K/Akt пути. Перечисленные изменения снижают захват глюкозы мышечными и жировыми клетками и потенцируют дальнейшие изменения на метаболическом уровне [8].
Воспаление и ИР
Связь воспаления и развития ИР известна довольно давно. Существуют неопровержимые клинические и экспериментальные доказательства того, что при ожирении в жировой ткани, мышцах и печени возникает хронический вялотекущий воспалительный процесс, способствующий развитию ИР и системных метаболических нарушений [19]. При ожирении за счет избыточного накопления жиров происходит увеличение размеров адипоцитов, объема жировой ткани, а также нарушения в выработке адипокинов, провоспалительных цитокинов и свободных жирных кислот [20].
В жировой ткани провоспалительные цитокины (резистин, ФНО-α, ИЛ-6, -18, -1β, моноцитарный хемотаксический фактор-1 и ангиотензин II [21, 22]) секретируются макрофагами, концентрация которых увеличивается при ожирении [23]. Они способствуют развитию местного и системного воспалительного ответа и, в случае влияния ФНО-α, ИЛ-6, -18, -1β и ангиотензина II, напрямую усиливают ИР [21–23]. Отдельно стоит отметить, что под влиянием ФНО-α, ИЛ-6 и -1β происходит избыточное фосфорилирование IRS по остаткам серина, снижение IRS-1 и GLUT-4, а также усиление экспрессии и активации супрессора передачи сигналов цитокина 3 [24, 25] (рис. 2).
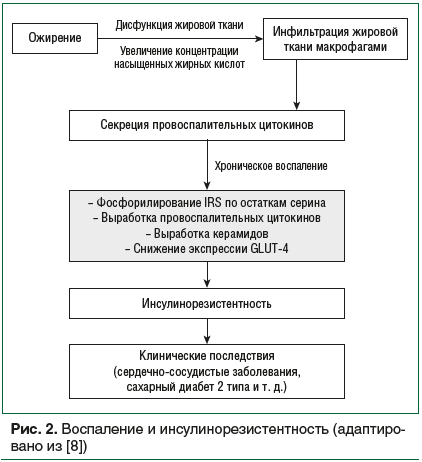
Увеличение концентрации насыщенных жирных кислот стимулирует выработку и накопление керамидов, жиров из семейства сфинголипидов, образующихся путем гидролиза сфингомиелина или синтеза из жирных кислот и сфингозина [26]. Керамиды нарушают действие инсулина на клетку-мишень, ингибируя передачу сигнала по PI3K/Akt пути и блокируя активацию анаболического фермента протеинкиназы В (Akt) [27]. Они также нарушают метаболизм жиров в печени, ингибируя окисление и стимулируя захват свободных жирных кислот [28].
В развитии ИР значительную роль играет снижение выработки адипонектина жировыми клетками [4]. Адипонектин увеличивает чувствительность тканей к действию инсулина, усиливает окисление жиров в мышечной ткани [29], а также способствует активации АМФ-зависимой протеинкиназы, которая играет решающую роль в метаболизме [4, 29]. В ряде исследований было показано, что после индукции оксидативного стресса в жировой ткани снижалась экспрессия адипонектина и увеличивалась концентрация ИЛ-6 [29–31].
Дисфункция клеточных органелл
Стресс эндоплазматического ретикулума. В условиях стресса на фоне повышенной нагрузки функциональные возможности эндоплазматического ретикулума (ЭР) истощаются, происходит нарушение его функции. Так, снижается транспорт белков в комплекс Гольджи, нарушается процесс укладки белка и истощаются запасы кальция. Подобные изменения получили название «стресс эндоплазматического ретикулума» [31, 32]. В ответ на накопление в ЭР неправильно свернутых белков запускается компенсаторный механизм, известный как развернутый белковый ответ [33]. Это ведет к активации трех стресс-зависимых киназ: PERK-киназы, инозитол-зависимой киназы IRE1 и фактора транскрипции ATF6 [34], которые потенцируют развитие ИР [32–34].
Дисфункция митохондрий. Инсулин обеспечивает нормальное функционирование митохондрий, поддерживая целостность митохондриальной цепи переноса электронов. Свободные радикалы, продуцируемые преимущественно в митохондриях, увеличивают чувствительность клеток к инсулину, однако их избыточное накопление нарушает передачу сигнала, приводя тем самым к ИР. Таким образом, оксидативный стресс играет значительную роль в развитии ИР (рис. 3) [34].

Основные подходы к коррекции ИР
Ожирение, ИР и ассоциированные с ними заболевания значительно способствуют инвалидизации пациентов, увеличивают расходы на здравоохранение, поэтому крайне важно вовремя выявлять и корректировать эти состояния. В основе патогенетического лечения ожирения и, как следствие, ИР лежит, прежде всего, немедикаментозная терапия. Она включает в себя снижение массы тела путем изменения пищевых привычек и повышения уровня физической активности, отказ от вредных привычек [36–39]. Согласно клиническим рекомендациям Российской ассоциации эндокринологов эффективной тактикой лечения является снижение массы тела на 5–10% за 3–6 мес. терапии и удержание результата в течение 1 года. При этом пациентам с индексом массы тела ≥35 кг/м 2 и коморбидными заболеваниями можно рекомендовать уменьшить массу тела на 15–20% и более [40]. Доказано, что снижение массы тела улучшает чувствительность тканей к инсулину и, как следствие, нормализует уровни гликемии и липидов [41]. При невозможности достижения клинически значимого снижения массы тела пациентам рекомендована медикаментозная терапия.
Препараты, оказывающие влияние на чувствительность к инсулину, традиционно разделены на 2 группы: бигуаниды (метформин) и тиазолидиндионы [41].
На сегодняшний день метформин является единственным представителем группы бигуанидов и самым часто назначаемым препаратом в терапии СД 2 типа и ранних нарушений углеводного обмена [42]. Метформин улучшает чувствительность тканей к инсулину, усиливая инсулинстимулированное фосфорилирование остатков тирозина инсулиновых рецепторов и увеличивая их количество на мембранах клеток. Он также повышает активность PI3К и уменьшает экспрессию ферментов глюконеогенеза и симпатическую активность. Метформин устраняет ИР преимущественно в печени, снижая гликогенолиз и глюконеогенез, оказывая умеренное действие на мышечную и жировую ткани [42]. Одними из самых частых побочных эффектов метформина являются желудочно-кишечные расстройства, что часто становится причиной его отмены.
Препараты класса тиазолидиндионов являются агонистами ядерных γ-рецепторов, которые активируются пролифераторами пероксисом (Peroxisome proliferator-activated receptors, PPAR—γ). Активация PPAR-γ рецепторов влияет на транскрипцию ряда генов, которые участвуют в передаче сигнала от инсулина клеткам и регулируют уровень глюкозы в крови и метаболизм жиров. Тиазолидиндионы усиливают PI3К/Akt путь передачи сигнала инсулина, одновременно ингибируя путь МАРК/RAS. Таким образом, они повышают чувствительность мышечной, жировой и печеночной тканей к действию инсулина, уменьшают содержание свободных жирных кислот в крови [8]. Вместе с тем применение в разных странах мира одного из представителей тиазолидиндионов — росиглитазона ограничено по причине высокой частоты развития на фоне его приема сердечной недостаточности и других сердечно-сосудистых осложнений [43].
Кроме бигуанидов и тиазолидиндионов в настоящее время в комплексной терапии СД применяется гипогликемический препарат Субетта, который не вызывает гипогликемию, оказывает ангиопротективное действие, улучшает микроциркуляцию [44]. В состав препарата входят афинно очищенные технологически обработанные антитела (высокие разведения) к C-концевому фрагменту β-субъединицы рецептора инсулина и к эндотелиальной NO-синтазе. Исследования на клеточных культурах (in vitro)
продемонстрировали увеличение чувствительности миоцитов человека к инсулину на 43%, что приводило к активации инсулин-зависимого пути утилизации глюкозы [45]. Кроме того, Субетта продемонстрировала возможность положительно влиять на синтез адипонектина, обеспечивающего метаболическую гибкость организма [46].
Клиническая эффективность Субетты была продемонстрирована в ряде двойных слепых плацебо-контролируемых исследований. Так, было показано, что включение препарата в состав сахароснижающей терапии приводит к существенному улучшению гликемического контроля со снижением уровня гликированного гемоглобина (HbA1c) на 0,7% [47]. Происходит это, вероятно, за счет снижения ИР, позитивный эффект наблюдается при тех же самых дозах сахароснижающих препаратов, включая базальный инсулин и пероральные сахароснижающие средства (метформин и/или препарат сульфонилмочевины).
Другое исследование в условиях реальной клинической практики показало снижение уровня HbA1c через 12 нед. после включения Субетты в схему лечения в среднем на 0,64% (с 8,32% до 7,68%, p Литература
Только для зарегистрированных пользователей
Источник

