Ишемия головного мозга крыс
Нарушения мозгового кровообращения различной этиологии являются одной из наиболее значимых нозологий и занимают второе место в структуре общей смертности. Разработка способов профилактики и лечения до настоящего времени является одной из актуальных проблем как клинической фармакологии, так и неврологии. Поиск и использование большого количества экспериментальных моделей ишемии головного мозга обусловлено различными вариантами нарушения мозгового кровообращения. Чтобы смоделировать в эксперименте тотальную ишемию головного мозга, используют четырёхсосудистую модель ишемии головного мозга. В этой модели создается окклюзия двух позвоночных и двух общих сонных артерий. Данный вариант патологии является одним из наиболее сложно выполнимых в техническом плане и позволяет получить тотальную ишемию мозга более чем у 90% животных [1; 10]. Оценку последствий ишемии головного мозга можно провести с помощью морфометрического изучения его срезов. Нейроны лобной доли, мозжечка и гиппокампа являются наиболее чувствительными к гипоксии и ишемии. Гиппокамп обеспечивает реализацию механизмов памяти, поведенческих реакций, выполняет функцию фиксации эмоционально значимых событий [2; 3; 5]. Функциональные, биохимические и морфологические признаки ишемии и повреждения нейронов фиксируются уже после 2-минутной ишемии [7; 9].
Цель исследования: провести морфометрическое исследование нейронов коры лобной доли головного мозга и СА1 области гиппокампа крыс при моделировании тотальной ишемии ГМ (головного мозга) и при коррекции тадалафилом.
Материал и методы исследования. Исследование выполнено на 40 половозрелых крысах-самцах линии Wistar массой 230-260 г. Экспериментальные животные были разделены на 4 группы: 1) контрольную (n=10), 2) группу с двухсосудистой патологией (n=10), 3) группу с четырехсосудистой патологией (n=10), 4) группу с патологией и коррекцией тадалафилом (1 мг/кг, в/б), (n=10). Животные содержались в стандартных условиях вивария НИУ «БелГУ» со свободным доступом к еде и воде. Содержание животных и постановка эксперимента проводилась в соответствии с требованием приказов № 1179 МЗ СССР от 11.10.1983 г. и № 267 РФ от 19.06.2003 г., а также по международным правилам Guide for the Care and of Laboratory Animals.
Животным 2-й группы моделировали двухсосудистую локальную ишемию: на 4 минуты перекрывали кровоток в общих сонных артериях. Крысам 3-й группы была смоделирована тотальная четырехсосудистая ишемия головного мозга с ишемическим периодом 4 минуты [8]. Животным 4-й группы за 60 минут до моделирования тотальной ишемии внутрижелудочно вводили ингибитор фосфодиэстеразы-5, тадалафил, в дозе 1 мг/кг.
Наркотизацию животных проводили препаратом «Золетил 100», 60 мг/мл, и хлоралгидратом, 150 мг/мл. Животных выводили из эксперимента через 72 часа с момента его начала путем передозировки наркозных препаратов.
Головной мозг извлекали из полости черепа, разрезали на 3 фрагмента и фиксировали в 10%-ном растворе нейтрального формалина в течение 2-3 суток. Для получения гистологических препаратов кусочки мозга заливали в парафин по стандартной методике, после чего изготавливали серийные срезы толщиной 4 мкм на сертифицированном ротационном микротоме Leica (Германия). Для гистологического и морфометрического исследования срезы окрашивали гематоксилином и эозином в автомате для окраски гистологических срезов и мазков (Autostaininer XL ST5010; Leica, Германия), а также тионином по методике Ниссля. Морфометрию выполняли после микроскопического исследования с помощью микроскопа «Leica DM 4000 B» и создания цифрового изображения на полуавтоматическом сканере Mirax Desk (Carl Zeiss Micrimaging GMbH, Германия). Для этого использовали программу «Pannoramic Viewer 1.15». Производили подсчёт неизмененных и гиперхромных нейронов пирамидного и полиморфного слоев СА1 области гиппокампа и нейронов лобной доли, измеряли больший и меньший диаметры перикарионов, их периметр и площадь, диаметр ядер и ядрышек, определяли относительное количество нейронов в нескольких полях зрения с последующим пересчетом на 0,01 мм². У каждого животного производили 30 измерений каждого планиметрического и количественного показателя с занесением данных в таблицу MS Excel и Statistica 10.0. Для всех данных была применена описательная статистика: данные проверены на нормальность распределения. Тип распределения определялся критерием Шапиро-Уилка. В случае нормального распределения были подсчитаны среднее значение (M) и стандартная ошибка среднего (m). В случаях ненормального распределения были рассчитаны медиана (Me) и квартильный размах (QR). Межгрупповые различия анализировались параметрическими (t-критерий Стьюдента) или непараметрическими (критерий Манна-Уитни) методами в зависимости от типа распределения. Различия были определены при 0,05 уровня значимости. Статистический анализ выполнен с помощью программного обеспечения Statistica 10.0.
Результаты исследования
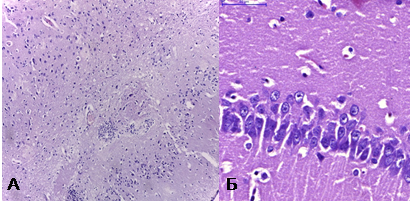
При обзорной микроскопии у интактных животных полученные нами результаты соответствовали описаниям цитоархитектонических особенностей лобной доли и гиппокампа [4; 6]. Нейроны были преимущественно пирамидной, округлой или многоугольной формы, с крупными округлыми ядрами и мелкозернистой цитоплазмой. У многих нейронов базофильная субстанция цитоплазмы имела вид крупных глыбок, расположенных периферически. В некоторых нейронах чётко определялись одно или два центрально расположенных ядрышка (рис. 1).
Рис. 1. А — лобная доля интактной крысы, X 100, окр. гематоксилин+эозин; Б – гиппокамп интактной крысы, X 400, окр. гематоксилин+эозин
Область лобной доли характеризовалась низкой плотностью расположения, а область СА1 гиппокампа высокой плотностью средних по размеру нейронов. Морфометрические изменения нейронов при двухсосудистой модели ишемии имели общую тенденцию к увеличению и характеризовались увеличением максимального и минимального диаметров перикарионов, их периметра и площади. Диаметр, площадь и периметр ядер нейронов также увеличивались. Общее количество гиперхромных нейронов составило 36,7%, а двуядрышковых — 16,7% (табл. 1). Изменения аналогичных показателей в области СА1 гиппокампа были менее значительны, однако общая тенденция к их увеличению прослеживалась (табл. 2).
Морфометрическая характеристика нейронов лобных долей головного мозга крыс (М±m; n=30)
Источник
Изменение биогенеза митохондрий в ткани головного мозга у животных в условиях церебральной ишемии
Д.И. Поздняков, доцент кафедры фармакологии с курсом клинической фармакологии, ORCID 0000-0002-5595-8182;
А.В. Мамлеев, доцент кафедры фармакологии с курсом клинической фармакологии, ORCID 0000-0001-9657-2246;
К.Х. Саркисян, доцент кафедры фармакологии с курсом клинической фармакологии, ORCID 0000-002-1756-0026
Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО «Волгоградский государственный медицинский университет»
357532, Россия, Ставропольский край, Пятигорск, пр. Калинина, д. 11
Е-mail: pozdniackow.dmitry@yandex.ru
Резюме
Митохондриальная дисфункция представляет собой универсальный патогенетический механизм, играющий существенную роль в ишемическом повреждении головного мозга. В то же время изучение митохондриального биогенеза позволит значительно улучшить эффективность целенаправленного терапевтического воздействия на митохондрии клетки.
Цель исследования. Оценить изменение митохондриального биогенеза в ткани головного мозга крыс в условиях перманентной фокальной ишемии.
Материал и методы. Церебральную ишемию моделировали у крыс-самцов путем необратимой правосторонней коагуляции средней мозговой артерии. Митохондриальный биогенез оценивали по изменению активности сукцинатдегидрогеназы и СОХ у крыс в динамике спектрофотометрическим методом. Также у крыс определяли изменение величины зоны некроза головного мозга по степени восстановления формазана трифенилтетразолия хлористого.
Результаты. Проведенное исследование показало, что наиболее выраженные изменения активности сукцинатдегидрогеназы и СОХ отмечены спустя 72 ч с момента моделирования ишемии. При этом в сравнении с ложнооперированными животными активность ферментов уменьшилась на 53,1% (p 60% (p СОХ коррелировало с увеличением зоны некроза головного мозга со значениями коэффициентов корреляции r=0,71324 и r=0,83629 соответственно.
Введение
Ишемический инсульт – заболевание с высоким уровнем летальности и инвалидизации населения. Ежегодно отмечается >50 млн случаев инсульта, из которых 6 млн оказываются летальными в острой фазе заболевания [1]. Во многом значимая медико-социальная и экономическая роль ишемического инсульта связана со сложным патогенезом данного состояния, который вовлекает целый каскад взаимосвязанных реакций. На сегодняшний день установлено, что весомой составляющей патогенеза церебральной ишемии является митохондриальная дисфункция, которая непосредственно связана с нарушением оптимального хода метаболических реакций, индукцией окислительного стресса, апоптоза и нейровоспаления [2]. Во многом негативные сдвиги, опосредующие развитие дисфункции митохондрий, связаны с нарушением их биогенеза. Известно, что в условиях ишемии клетки, испытывающие дефицит кислорода, не способны синтезировать достаточное количество белка, в том числе и митохондриального, что ведет к снижению интенсивности репаративных процессов в митохондриальной мембране и уменьшению синтеза митохондрий de novo [3]. Основными маркерами митохондриального биогенеза является изменение активности сукцинатдегидрогеназы и СОХ . Сукцинатдегидрогеназа как составляющая цикла Кребса окисляет сукцинат до фумарата и как компонент митохондриальной дыхательной цепи – убихинон до убихинола [4]. СОХ – терминальная оксидаза митохондриальной дыхательной цепи, катализирующая реакцию переноса электронов от ферроцитохрома С к молекулярному кислороду, создающая электрохимический градиент, необходимый для синтеза аденозинтрифосфата (АТФ) [5]. Несмотря на то, что существенная роль изменения функциональной активности митохондрий в патогенезе ишемического инсульта не вызывает сомнений, временной промежуток развития митохондриальной дисфункции при ишемии головного мозга в настоящее время не установлен, тогда как определение начала деструктивных процессов в «энергетических станциях» позволит оптимизировать стратегии нейропротекторной терапии.
Цель исследования – оценить изменение митохондриального биогенеза в ткани головного мозга крыс в условиях перманентной фокальной ишемии.
Материал и методы
Исследование выполнено на 160 крысах-самцах линии Wistar, которые были получены из питомника лабораторных животных «Рапполово» и на время исследования содержались в контролируемых условиях вивария в соответствии с требованиями ARRIVE 2.0 [6]. Ишемию головного мозга моделировали путем постоянной окклюзии средней мозговой артерии под хлоралгидратной анестезией (350 мг/кг, внутрибрюшинно), как описано A. Tamura и соавт. [7]. У ложнооперированных (ЛО, n=20) животных использовали все последовательные процедуры, за исключением коагуляции артерии. Активность митохондриального биогенеза оценивали через 6, 12, 24, 48, 72, 96 и 120 ч с момента ишемии. Количество животных в каждой контрольной точке равнялось 20 особям. В качестве биоматериала брали головной мозг экспериментальных животных. 10 крыс из группы декапитировали под хлоралгидратной анестезией, извлекали головной мозг, который гомогенизировали в фосфатно-солевом буфере (рН 7,4). Митохондриальную фракцию получали путем дифференциального центрифугирования в градиенте 10% перколла [8]. Активность СОХ определяли в митохондриальной фракции по изменению оптической плотности среды реакции окисления цитохрома С (II) в присутствии KCN при 500 нм [9]. Активность сукцинатдегидрогеназы оценивали спектрофотометрически в реакции сукцинатзависимого восстановления дихлорфенолиндофенола при добавлении в анализируемую среду ротенона при 600 нм [10]. Оптическую плотность смесей регистрировали на спектрофотометре ПРОМЭКОЛАБ ПЭ-5300В в кюветах с длиной оптического пути 10 мм. Активность ферментов выражали в Единицах на 1 мг белка. Концентрацию белка в анализируемом образе оценивали по методу Бредфорда в реакции аминокислотных остатков с красителем Coomasie Brilliant Blue (кумасси голубой). Изменение зоны некроза оценивали у 10 оставшихся животных из группы, используя трифенилтетразолиевый ме-тод [11]. Полученные результаты статистически обрабатывали и выражали в виде M±SEM (среднее значение ± стандартная ошибка среднего). Сравнение средних осуществляли методом однофакторного дисперсионного анализа с постобработкой тестом Ньюмена–Кейлса при уровне значимости p Спирмену. Статистическую обработку данных проводили в прикладном программном пакете Statistica 6.0 (Statsoft, США).
Результаты
В ходе исследования было установлено, что активность сукцинатдегидрогеназы и СОХ у животных ЛО составляла 3,2±0,2 и 1,5±0,4 Ед на 1 мг белка (рис. 1). У крыс с ишемией головного мозга через 6 ч с момента воспроизведения ишемического повреж-дения головного мозга отмечено снижение активности сукцинатдегидрогеназы и СОХ в сравнении с аналогичными показателями животных ЛО на 15,6% (p дальнейшем у ишемизированных крыс отмечалось прогрессирующее уменьшение ферментативной активности СОХ и сукцинат-дегидрогеназы. Так, через 12 ч ишемии активность сукцинатдегидрогеназы снизилась на 25% (p 27,2% (p животных с ишемией составляла 33,2%. В дальнейшем рост области инфаркта мозга не отмечался (рис. 2).
Учитывая, что максимальные изменения не только маркеров митохондриального биогенеза, но и величины зоны инфаркта мозга отмечены через 72 ч с момента воспроизведения ишемии, корреляции рассчитывали между результатами, полученными на 3-й день исследования. Проведенный корреляционный анализ показал, что имеется сильная корреляция (рис. 3) между величиной некротического очага и снижением активности СОХ (r=0,83629).
Также умеренная корреляционная зависимость выявлена между уменьшением активности сукцинатдегидрогеназы (рис. 4) и увеличением зоны некроза мозга (r=0,71324).
Обсуждение
Митохондрии – клеточные органеллы, чрезвычайно чувствительные к дефициту кислорода и субстратов окисления. Однако в условиях ишемии могут активироваться репаративные процессы, где в ходе последовательных реакций митофагии/биогенеза дефектные митохондрии заменяются на нормальной функционирующие, что чрезвычайно важно для сохранения жизнеспособности непролиферативных нейронов [12]. Проведенное исследование показало, что по мере прогрессирования ишемического процесса с 6 до 72 ч наблюдается стойкое снижение митохондриального биогенеза, сопровождаемое увеличением зоны некроза мозга, что может быть связано с критическим снижением синтеза АТФ и инициацией апоптотической программы в нейронах ишемической «пенумбры» [13]. На пике наблюдаемых изменений (72 ч с момента индукции ишемии) отмечалась стойкая корреляционная зависимость между изменениями зоны инфаркта мозга и маркерами митохондриального биогенеза – активностью СОХ и сукцинадегидрогеназы, причем более сильная корреляция установлена в случае СОХ, что, вероятно, связано с многогранной ролью данного энзиматического комплекса в совокупной митохондриальной функции, включая регуляцию апоптоза и продукции активных форм кислорода. В дальнейшем процессы митохондриального биогенеза стабилизировались и несколько увеличились, отражая активацию компенсаторных биогенетических процессов, зависимых от 1α-коактиватора γ-рецептора, активируемого пролифератором пероксисом (PGC-1α), на уровне генома, регулирующего экспрессию митохондриального белка [14].
Заключение
Данные, полученные в ходе исследования, позволяют говорить о снижении митохондриального биогенеза в мозговой ткани при увеличении зоны некротического очага с пиком спустя 72 ч ишемического периода и последующим восстановлением биогенетических процессов митохондрий.
Сокращения
ЛО- ложнооперированные животные
PGC-1α – 1α ко-активатор γ рецептора, активируемого пролифератором пероксисом
Вклад авторов
Д.И. Поздняков – разработка концепции исследования, проведение экспериментов, написание рукописи.
А.В. Мамлеев – постановка экспериментов, сбор данных, участие в анализе результатов
К.Х. Саркисян – статистическая обработка данных, подготовка конченого варианта рукописи и ее критическая оценка.
Сведения о конфликте интересов
Авторы заявляют об отсутствии конфликта интересов.
Источник