Бета-амилоид – компонент врожденного иммунитета?
В статье «The Alzheimer’s Disease-Associated Amyloid β-Protein Is an Antimicrobial Peptide», опубликованной в журнале PLoS One от 3 марта, исследователи, работающие под руководством Роберта Моира (Robert D. Moir) из Центральной больницы штата Массачусетс, описывают полученные ими доказательства антимикробных свойств бета-амилоида. Судя по всему, этот белок является компонентом врожденного иммунитета, обеспечивающим защиту организма от широкого спектра патогенов.
Врожденный иммунитет является первой линией защиты организма от проникающих в него патогенов. Запуск механизмов врожденного иммунного ответа обеспечивает быструю мобилизацию лейкоцитов и химических факторов, таких как цитокины и антимикробные пептиды, на борьбу с бактериями, вирусами, грибками и даже опухолевыми клетками. Антитела и другие компоненты приобретенного иммунного ответа практически не проникают в окруженные гематоэнцефалическим барьером ткани головного мозга, поэтому защита центральной нервной системы от инфекций преимущественно является задачей антимикробных пептидов.
Бета-амилоид токсичен для нейронов и его накопление, приводящее к появлению характерных бляшек в тканях мозга пациентов с болезнью Альцгеймера, считается причиной развивающихся при этом заболевании симптомов нейродегенерации. Этот протеин является продуктом ферментативного расщепления более крупных молекул белка-предшественника, при котором образуется несколько типов молекул бета-амилоида. Наиболее распространенные из них – бета-амилоид-40 и бета-амилоид-42 – особенно склонны к формированию токсичных бляшек. Известно, что бета-амилоид стимулирует воспалительные процессы, а его биологическая активность до сих пор считалась исключительно патогенной. Однако авторы получили доказательства того, что на самом деле бета-амилоид обладает антимикробными свойствами и может играть важную роль в защите головного мозга от инфекций.
Сначала ученые заметили, что бета-амилоид обладает определенным физическим, химическим и биологическим сходством с антимикробными белками, в особенности человеческим кателицидином LL-37. С целью изучения этого феномена они провели параллельное тестирование микробицидной активности бета-амилоидов-40 и -42 и LL-37 с помощью панели из 15 наиболее важных патогенов. В результате оказалось, что бета-амилоид подавляет рост восьми из них. При этом, по сравнению с LL-37, бета-амилоид-40 был более эффективен против семи, а бета-амилоид-42 – против шести из этих микроорганизмов, в том числе против дрожжеподобного грибка Candida albicans и определенных штаммов листерий, стрептококков и стафилококков.
Для изучения антимикробной активности бета-амилоида, ассоциированного с болезнью Альцгеймера, исследователи протестировали способность посмертных образцов гомогенизированной ткани мозга пациентов с болезнью Альцгеймера и контрольных индивидуумов такого же возраста подавлять рост дрожжеподобного грибка Candida albicans в культуре. Наибольшая концентрация бета-амилоидных бляшек, как правило, наблюдается в лобных долях головного мозга, и образцы этих участков мозга пациентов с болезнью Альцгеймера в значительной степени подавляли рост грибков, чего не наблюдалось в культурах, в которые вносили контрольные образцы ткани. При этом степень микробицидности образцов была прямо пропорциональна количеству содержащегося в них бета-амилоида, а внесение в культуру антител к бета-амилоиду возобновляло рост возбудителей. Результаты второго эксперимента, при проведении которого использовались образцы ткани мозжечка, для которого характерно наиболее низкое содержание бета-амилоида, как в экспериментальной, так и в контрольной постановках продемонстрировали отсутствие антимикробной активности.
Авторы предполагают, что продолжительная активация механизмов врожденного иммунитета в результате хронической или перенесенной инфекции центральной нервной системы может приводить к избыточной продукции и накоплению бета-амилоида. Известные факторы риска развития болезни Альцгеймера, такие как инсульт, черепно-мозговые травмы и воздействие определенных анестетиков, также могут запускать механизмы врожденного иммунного ответа и стимулировать продукцию бета-амилоида.
Тогда как редкая мутация, непосредственно вызывающая развитие наследственной формы болезни Альцгеймера, стимулирует синтез бета-амилоида-42, несколько недавно идентифицированных генов, предположительно играющих роль в патогенезе заболевания, участвуют в формировании врожденного иммунитета. В настоящее время исследователи проверяют гипотезу, согласно которой комплекс генетических факторов может повышать вероятность развития болезни Альцгеймера посредством активации механизмов врожденного иммунитета и, соответственно, стимуляции синтеза бета-амилоида.
Авторы считают, что идентификация патогенов, наиболее склонных к запуску синтеза бета-амилоида, позволит разработать методы профилактики и подавления этого механизма, например, посредством иммунизации.
Источник
Разрушить бляшки
Болезнь Альцгеймера начинается задолго до появления клинических признаков. Амилоидные бляшки, повреждающие ткань мозга, считаются основным патогенетическим фактором болезни. Исследователи сходятся во мнении, что борьба с этими бляшками поможет остановить прогрессирование заболевания или даже полностью излечить пациента.
Бляшки, накапливающиеся при болезни Альцгеймера, состоят в основном из патологического белка бета-амилоида. Но внутри них в небольшом количестве содержится другой белок – аполипопротеин Е (APOE). Группа исследователей из Вашингтонского университета под руководством Дэйвида Холтцмана (David Holtzman) продемонстрировала стратегию борьбы с бляшками с помощью антител, нацеленных на белок APOE.
Амилоидные бляшки, разрушающие мозг, формируются годами. Поэтому избавиться от них достаточно сложно, особенно в запущенных стадиях болезни. Как пишут исследователи, начинать лечение описанным ими методом желательно еще в доклинической стадии. Кроме того, чем меньше бляшки контактируют с тканью мозга, тем меньше необратимых изменений произойдет и выше шанс на выздоровление.
Ученые предложили использовать антитела, которые распознают и связывают белок APOE. Формирующийся в результате комплекс антитело-APOE привлекает иммунные клетки, они начинают разрушать его. В процессе уничтожается не только APOE, но и расположенный рядом бета-амилоид.

Антитела к APOE (красные) связываются с амилоидными бляшками (синими).
Для подтверждения своей гипотезы in vivo авторы заменили мышам гены, кодирующие APOE, на человеческий аналог. В течение шести недель им раз в неделю вводили плацебо или антитела к APOE. После курса терапии определяли количество бляшек в головном мозге. Таким образом было испытано несколько типов антител.
В результате было выбрано антитело HAE-4. Его введение привело к сокращению количества амилоидных бляшек на 50%, при этом уровень белка APOE в крови никак не менялся. APOE играет важную роль в транспорте липидов и холестерина, поэтому снижение его уровня в крови на фоне лечения привело бы к развитию серьезных побочных эффектов в виде нарушения обмена веществ.
Антитело HAE-4 эффективно связывалось с APOE в головном мозге и никак не реагировало на APOE, циркулирующий в крови, из-за особой структуры белка в составе бляшки.
Многие лаборатории по всему миру пытаются использовать антитела в качестве лечения болезни Альцгеймера. Но проблема заключается в том, что ни один метод, в котором антитела нацелены на бета-амилоид, не доказал свою безопасность: слишком высок риск осложнений в виде воспаления или отека мозга.
Антитела, нацеленные на APOE, могут стать эффективным методом лечения с более низким риском осложнений в виде реакции иммунной системы. Дело в том, что бета-амилоида накапливается гораздо больше, чем APOE, поэтому анти-APOE могут оказать более щадящее действие, чем антиамилоидные антитела.
Исследования безопасности и эффективности антител к APOE будут продолжаться.
Статья F. Liao et al. Targeting of non-lipidated, aggregated apoE with antibodies inhibits amyloid accumulation будет опубликована в Journal of Clinical Investigation.
Источник
Как избавиться от амилоидных бляшек
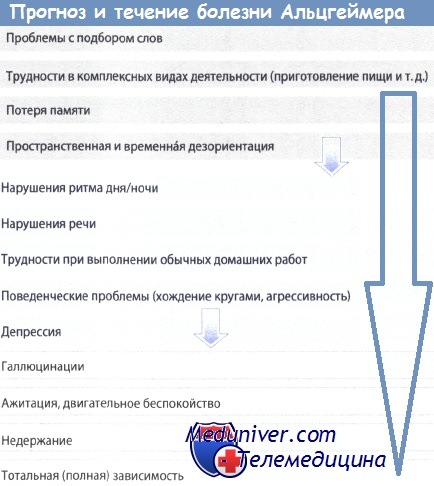
Болезнь Альцгеймера определяют как преждевременное старение мозга. Оно начинается в середине взрослой жизни и быстро прогрессирует до чрезвычайной потери умственных способностей, что обычно бывает в очень старом возрасте. Клинические признаки болезни Альцгеймера включают: (1) амнестический тип поражения памяти; (2) ухудшение речи; (3) дефицит зрительно-пространственного восприятия.
Моторных и сенсорных нарушений, изменений походки и судорожных приступов обычно не бывает вплоть до поздних стадий болезни. С этими симптомами согласуется тот факт, что при болезни Альцгеймера обнаруживается потеря нейронов в той части лимбического пути, который стимулирует процесс памяти. Потеря памяти при этой болезни огромна.
Болезнь Альцгеймера является прогрессирующим и летальным нейродегенеративным поражением, в результате которого нарушается способность человека выполнять действия, необходимые для повседневной жизни, а на поздних стадиях болезни также развивается ряд нейропсихиатрических симптомов и нарушений поведения. Обычно через несколько лет после начала болезни Альцгеймера больные нуждаются в постоянном уходе.
Болезнь Альцгеймера представляет наиболее распространенную форму старческого слабоумия, и около 5 млн людей в США страдают этой болезнью. Процент пораженных болезнью Альцгеймера среди людей старшего возраста примерно удваивается через каждые 5 лет старения. Так, среди 60-летних больных примерно 1%, а среди 85-летних людей количество пораженных болезнью Альцгеймера возрастает до 30%.
а) Болезнь Альцгеймера сопровождается накоплением мозгового бета-амилоидного пептида. При гистологическом исследовании в мозге пациентов с болезнью Альцгеймера находят увеличенное количество бета-амилоидного пептида. Пептид накапливается в амилоидных бляшках, диаметр которых колеблется от 10 мкм до нескольких сотен микрометров. Их обнаруживают в широко распространенных областях мозга, включая кору большого мозга, гиппокамп, базальные ганглии, таламус и даже мозжечок. Таким образом, болезнь Альцгеймера, по-видимому, является метаболическим дегенеративным заболеванием.
О ключевой роли избыточного количества бета-амилоидного пептида в патогенезе болезни Альцгеймера свидетельствуют следующие наблюдения:
(1) все известные в настоящее время мутации, связанные с болезнью Альцгеймера, увеличивают продукцию бета-амилоидного пептида;
(2) больные с трисомией 21 (синдромом Дауна) имеют три копии гена для пептида, предшественника амилоида, к середине жизни у них развиваются неврологические характеристики болезни Альцгеймера;
(3) у больных с патологией гена, контролирующего синтез аполипопротеина Е, белка крови, транспортирующего холестерол к тканям, ускоряется отложение амилоида, и существует очень высокий риск развития болезни Альцгеймера;
(4) у трансгенных мышей с гиперпродукцией белка-предшественника человеческого амилоида резко ослаблена способность к обучению и запоминанию в связи с накоплением амилоидных бляшек;
(5) образование анти-амилоидных антител у людей с болезнью Альцгеймера, по-видимому, смягчают болезненный процесс.
б) Сосудистые поражения могут вносить вклад в развитие болезни Альцгеймера. Поражения сердечно-сосудистой системы, связанные с гипертензией и атеросклерозом, могут играть определенную роль в болезни Альцгеймера. Болезни сердечно-сосудистой системы являются второй наиболее частой причиной приобретенных нарушений когнитивных функций и деменции и, вероятно, вносят вклад в ухудшение когнитивных способностей при болезни Альцгеймера.
Считается, что многие из общепризнанных факторов риска сердечно-сосудистых болезней, например гипертензия, диабет и гиперлипидемия, также значительно увеличивают риск развития болезни Альцгеймера.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Источник
Амилоидные бляшки при болезни Альцгеймера – «уборка» биологического мусора?
Один из главных признаков болезни Альцгеймера – накопление в тканях головного мозга амилоидных бляшек из патологического белка, что считается основной причиной развития заболевания. Однако методы, нацеленные на избавление от них, раз за разом терпят неудачу в клинических испытаниях. Недавнее исследование не только объясняет возможную причину неудач антиамилоидной терапии, но и в корне меняет взгляды на образование плотных скоплений патологического белка
При болезни Альцгеймера – нейродегенеративном заболевании, развивающимся преимущественно в пожилом возрасте, – человек теряет память, у него ухудшается мышление, изменяется поведение. Итог – развитие старческого слабоумия. И на фоне роста продолжительности жизни благодаря достижениям медицины эта болезнь, как и другие возрастные заболевания, встречается все чаще: по прогнозам, к 2050 г. число таких больных в мире достигнет 100 млн.
Почему болезнь Альцгеймера до сих пор является неизлечимой? Еще четверть века назад была предложена амилоидная гипотеза развития этого заболевания, связанная с отложением в тканях мозга белка бета-амилоида. Амилоидные бляшки могут быть разных типов, самые распространенные – диффузные, представляющие собой слабо организованные аморфные «облака», а также плотные, с компактным центром.
Последние служат объектами особого внимания ученых: было сделано несколько попыток создать лекарство от болезни Альцгеймера на основе моноклональных антител, способных снижать численность плотных амилоидных бляшек, но результаты клинических испытаний были как минимум неоднозначны.
Считается, что оба типа амилоидных бляшек образуются в мозге спонтанно, а уничтожают их клетки микроглии – иммунные клетки мозга. Микроглия должна работать, как и другие макрофаги: эти клетки имеют белки-рецепторы семейства ТАМ, с помощью которых они распознают, а затем «съедают» отжившую свое клетку. При этом клетка, подлежащая уничтожению, должна сигнализировать об этом определенной молекулой на поверхности – «сигналом смерти».
Именно такой молекулярный сигнал присущ и амилоидным образованиям. Недавно ученые из Института биологических исследований Солка (США) с использованием лабораторных мышей, служащих моделью болезни Альцгеймера, выяснили, что клетки микроглии, несущие рецепторы ТАМ, способны поглощать диффузный бета-амилоид. Внутри этих клеток поглощенные белковые фибриллы уплотняются, и именно из них формируется плотная бляшка.
По мнению исследователей, речь идет о защитном механизме, с помощью которого происходит структурная «организация» более опасного для нейронов диффузного бета-амилоида, в результате чего межклеточное пространство очищается от этого «мусора». Более того, они предполагают, что увеличение активности рецепторов ТАМ в клетках микроглии и связанное с этим ускорение образования плотных бляшек помогает смягчить симптомы болезни Альцгеймера. Эту гипотезу ученые планируют проверить экспериментально.
В заключение авторы предлагают перестать искать способы разрушения амилоидных бляшек, а заняться методами, которые позволят уменьшить синтез патологического белка либо улучшить его выведение из тканей мозга.
Источник