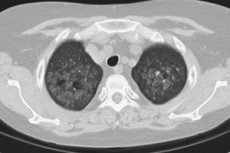
Восстановление легких после коронавируса
Восстанавливаются ли легкие после COVID-19? Да. Но нужно не пропустить сроки реабилитации и серьёзно отнестись к рекомендациям врача.
Новая коронавирусная инфекция, вызванная SARS-CoV-2, недостаточно изучена, однако ясно, что она наносит вред всем органам и тканям человека. Вирус проникает в организм через слизистые оболочки носа, глаз, глотки. Первые симптомы появляются на 2-14 день. Обычно это повышение температуры выше 37.5 градусов Цельсия, насморк, потеря обоняния, сухой кашель, послабление стула, слабость и головная боль. На 6–10 сутки от момента появления первых симптомов могут начать беспокоить одышка, боль в груди, усиление кашля. Это тревожные симптомы, говорящие о поражении легких и требующие проведения дополнительного обследования: компьютерной томографии легких, измерения насыщения крови кислородом (сатурации).
Легкие после COVID-19
Попадая в организм человека через слизистые оболочки дыхательных путей SARS-CoV-2 вызывает мощнейшую воспалительную реакцию. Активируются иммунные клетки, вырабатывается колоссальное количество воспалительных веществ (воспалительных цитокинов). Интенсивность этой реакции скорее всего обусловлена генетически. Именно интенсивностью воспалительной реакции и определяется тяжесть поражения легочной ткани по данным исследований. В легочной ткани поражение при COVID-19 обусловлено как поражением самих альвеол (в которых происходит газообмен и кровь насыщается кислородом из воздуха) нашими собственными иммунными клетками так и поражением легочных сосудов, оплетающих альвеолы. Степень поражения легких можно определить при помощи КТ (компьютерной томографии).
Таблица 1. Поражение лёгких при COVID-19
Процент поражения легочной ткани
Поражена часть лёгкого. Небольшое затруднение дыхания.
Источник
Кальциноз: что это такое, как лечить?
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Что значит кальциноз? Это образование скоплений нерастворимых кальциевых солей там, где их наличие не предусмотрено ни с анатомической точки зрения, ни с физиологической, то есть вне костей.
Среди всех биогенных макроэлементов человеческого организма доля кальция – в форме кристаллов гидроксилапатита костной ткани – самая значительная, хотя кровь, клеточные мембраны и внеклеточная жидкость тоже содержат кальций.
И если уровень данного химического элемента значительно повышен, то развивается кальциноз – нарушение минерального обмена (код Е83 по МКБ-10).

Код по МКБ-10
Причины кальциноза
Метаболизм кальция – многоступенчатый биохимический процесс, и на сегодняшний день ключевые причины кальциноза, как одной из разновидностей нарушения минерального обмена, определены и систематизированы. Но, с учетом тесной взаимосвязи всех протекающих в организме обменных процессов, в клинической эндокринологии принято одновременно рассматривать и патогенез отложения кальцинатов (или кальцификатов).
Первостепенной причиной известковой дистрофии признана перенасыщенность крови кальцием – гиперкальциемия, этиологию которой связывают с повышенным остеолизом (разрушением костной ткани) и высвобождением кальция из костного матрикса.
Из-за гиперкальциемии, а также гипертиреоза или патологий паращитовидных желез сокращается выработка щитовидной железой кальцитонина, который регулирует содержание кальция, угнетая его выведение из костей. Предполагается, что именно наличие скрытых проблем со щитовидной железой у женщин в период постменопаузы – в совокупности со снижением уровня эстрогенов, удерживающих кальций в костях – появляются внекостные кальциевые отложения, то есть развивается кальциноз при остеопорозе.
Есть и другие патологические состояния, которые заставляют кальциевые соли концентрироваться в неположенных местах. Так, у пациентов с первичным гиперпаратиреозом, гиперплазией паращитовидных желез или их гормонально активной опухолью синтез паратиреоидного гормона (паратгормона или ПТГ) возрастает, в результате чего подавляется действие кальцитонина, а уровень кальция в плазме крови, как и деминерализация костей, повышается.
Необходимо учитывать важность фосфора в метаболизме кальция, потому что нарушение пропорций содержания этих макроэлементов в организме ведет к гиперфосфатемии, которая усиливает образование «залежей кальция» и в кости, и в мягких тканях, и в кровеносных сосудах. А перенасыщение кальциевыми солями паренхимы почек приводит к почечной недостаточности и развитию нефрокальциноза.
Механизм повышенного остеолиза с выходом фосфата и карбоната кальция из костных депо при наличии раковых опухолей любой локализации объясняют так называемым паранеопластическим синдромом: рост злокачественных неоплазий сопровождается гиперкальциемией, так как мутировавшие клетки способны продуцировать полипептид, по действию подобный паратгормону.
Общеизвестно, что патогенез образования кальциевых солей может быть обусловлен избытком витамина D, с которым в эндокринологии связывают увеличение синтеза 1,25-дигидрокси-витамина D3 – кальцитриола, активно участвующего процессе метаболизма кальция и фосфора. Причастны к развитию известковой дистрофии гипервитаминоз витамина А, приводящий к остеопорозу, а также дефицит поступающего с пищей витамина K1 и эндогенного витамина K2.
При отсутствии эндокринных патологий содержание в плазме крови общего кальция не выходит за пределы физиологической нормы, и тогда причины кальциноза иные, обусловленные местными факторами. В их числе осаждение фосфата кальция на мембранах органоидов поврежденных, атрофированных, ишемизированных или погибших клеток, а также повышение уровня рН жидкости межклеточного пространства из-за активизации щелочных гидролитических ферментов.
Например, процесс обызвествления в случае атеросклероза сосудов представляется так. Когда осевший на стенке сосуда холестерин покрывается оболочкой, формирующейся из гликопротеиновых соединений эндотелия, образуется холестериновая бляшка. И это классический атеросклероз. Когда же ткани оболочки атероматозной бляшки начинают «пропитываться» солями кальция и затвердевают, это уже атерокальциноз.
Далеко не последнее место в этиологии нарушения кальциевого обмена отводится сдвигу водородного показателя кислотности крови (pH) в щелочную сторону при частичной дисфункции физико-химической буферной системы крови (бикарбонатной и фосфатной), поддерживающей кислотно-щелочное равновесие. Одной из причин его нарушения, приводящего к алкалозу, признан синдром Бернетта, который развивается у тех, кто употребляет много содержащих кальций продуктов, принимая от изжоги или гастрита пищевую соду или нейтрализующие кислоту желудочного сока антациды, адсорбирующиеся в ЖКТ.
Считается, что любое из названных выше эндокринных нарушений усугубляет чрезмерное поступление кальция с пищевыми продуктами. Однако, как утверждают исследователи Harvard University, до сих пор нет веских подтверждений того, что кальций пищи повышает вероятность кальцификации тканей, поскольку не вызывает стойкого повышения уровня Са в крови.

Источник
Метод КТ-диагностики для выявления фиброза легких
Фиброз — это разрастание соединительной ткани с появлением рубцов из-за нарушения механизмов заживления раневой поверхности.
Когда заживление протекает неправильно, могут возникать рубцовые изменения, приводящие к тому, что орган не может функционировать в полном объеме.
Соответственно, фиброз легких представляет собой рубцовые изменения ткани легких. Количество клеток, способных насыщать кровь кислородом, уменьшается. Следовательно, снижается дыхательная эффективность — развивается дыхательная недостаточность, приводящая к интоксикации, сначала при нагрузке, при усугублении течения заболевания — в покое, а далее — даже во сне. Рубцовая ткань в легких не только обладает пониженными функциональными свойствами, но и служит прекрасной средой для развития присоединенных инфекций, например, таких как бактериальная (пневмококковая или стафилококковая) пневмония.
Фиброз легких — это исход воспаления тканей во время интерстициального (то есть с поражением межклеточной соединительной ткани) заболевания легких. К причинам развития подобного заболевания могут относиться травмы легких, высокая загрязненность окружающей среды, курение, вдыхание наркотических веществ, плесени, органической, асбестовой, кварцевой и угольной пыли, инфекционные, аутоиммунные, вирусные заболевания и их осложнения — бронхит, туберкулез, пневмония, COVID-19 и многое другое.
Еще недавно синонимом самих интерстициальных заболеваний был пневмофиброз, но, к счастью, было установлено, что не все варианты таких заболеваний легких являются фиброзирующими.
Самый сложный и практически не поддающийся лечению — первичный, или идиопатический фиброз легких — быстро прогрессирующее фиброзирующее заболевание легких, причина которого неизвестна.
Симптомы фиброза легких
Легочный фиброз характеризуется симптомами одышки и сухого кашля (редко продуктивного — с мокротой) при физической нагрузке, непрекращающейся болью в области грудной клетки, быстрой утомляемостью на фоне затрудненного дыхания, похудением без изменения диеты. При аускультации легких (выслушивании с помощью фонендоскопа) выявляются ранние (в фазе вдоха) инспираторные, то есть дыхательные хрипы, чаще всего локализующиеся в нижних задних зонах легких.
Фиброз может развиваться как в одном легком, так и в двух одновременно. Также возможны очаговая и тотальная формы фиброза. При тотальной форме зачастую требуется оперативное вмешательство, так как поражена большая часть легких. При очаговой форме изменения носят локальный характер.
КТ-диагностика фиброза легких
Золотой стандарт диагностики фиброза легких — компьютерная томография высокого разрешения. КТ-диагностика легочного фиброза позволяет достоверно выявить степень поражения легких, определить локализацию рубцовой ткани. Этот метод диагностики признан одним из самых чувствительных неинвазивных методов выявления легочного фиброза. Так, проведенные сравнительные исследования уже в 1990 году показали, что фиброз легких с помощью компьютерной томографии в режиме высокого разрешения (КТВР) был обнаружен в 91% случаев и только в 39% — с использованием рентгенографии органов грудной клетки.
При наличии фиброза легких в серьезной стадии на КТ виден паттерн (термин, принятый для обозначения патологических признаков в медицине) так называемого «сотового» легкого — это состояние видно на сканах как однотипные, расположенные в несколько рядов кисты, содержащие воздух, в пораженных частях одного или обоих легких. На ранних стадиях легочного фиброза подобная картина не наблюдается, поэтому потребовался поиск признаков на КТ, позволяющих выявить болезнь в ее начале. Одним из таких признаков оказалось наличие на снимках картины «матового стекла» — очагов незначительного уплотнения легочной ткани. Также специфические признаки фиброза у пациента можно обнаружить при проведении КТ легких с функциональными пробами. Так, один из признаков — субплевральное усиление периферического легочного интерстиция — ранее считался признаком отсутствия патологии. Подобные изменения практически невозможно отследить при помощи других методов аппаратной диагностики.
На данный момент точность методов КТ-диагностики растет благодаря введению новых протоколов исследований и тщательного изучения результатов многочисленных исследований. При этом ведущая роль в диагностическом процессе отводится врачу-рентгенологу, который трактует видимые изменения как легочный фиброз или его отсутствие. Поиск ранних лучевых признаков фиброзирующей болезни легких — ключевой момент для своевременного назначения противофибротической терапии.
Также именно мультисрезовая КТ при поставленном диагнозе используется для оценки скорости прогрессирования заболевания, выявления благоприятного и неблагоприятного типов фиброзных изменений, успеха лечения и правильности подбора терапевтический препаратов.
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
- Чучалин А. Г., Авдеев С. Н., Айсанов З. Р. и др. Диагностика и лечение идиопатического легочного фиброза. Федеральные клинические рекомендации // Пульмонология. — 2016.
- Keith C Meyer. Pulmonary fibrosis, part I: epidemiology, pathogenesis, and diagnosis. — 2017.
- Victor J Thannickal, Galen B Toews, Eric S White, Joseph P Lynch 3rd, Fernando J Martinez. Mechanisms of pulmonary fibrosis. — 2004.
- Mark E Deffebach, MDLinda Humphrey, MD, Patient education: Lung cancer prevention and screening (Beyond the Basics), 2020.
- Paul W Noble, Christina E Barkauskas, Dianhua Jiang. Pulmonary fibrosis: patterns and perpetrators. — 2012.
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
Если вы оставили заявку после 22:00, мы перезвоним вам после 8:00.
Источник
Кальциопенические состояния и их коррекция
Кальций (Са) — один из важнейших элементов в организме человека, особенности его метаболизма обусловливают физиологический гомеостаз и нормальное функционирование практически всех систем организма [1]. Наибольшее значение содержание и состояние метаболизм
Кальций (Са) — один из важнейших элементов в организме человека, особенности его метаболизма обусловливают физиологический гомеостаз и нормальное функционирование практически всех систем организма [1]. Наибольшее значение содержание и состояние метаболизма кальция имеет в детстве, пожилом возрасте, а также в период беременности [2].
Общие сведения о кальции. Кальций является самым распространенным элементом в теле человека, поэтому его относят к «макроэлементам». Организм взрослого в норме содержит примерно 25 000 ммоль (примерно 1000 г) кальция, из них 99% входят в состав скелета. Общее содержание минеральных веществ в человеческом организме — около 5% от массы тела, а на долю Са приходится почти треть от их общего количества [3].
По химическим свойствам Са относится к элементам, образующим прочные соединения с белками, фосфолипидами, органическими кислотами и другими веществами.
Функции Са. Кальций выполняет многочисленные функции в минеральном обмене, но этим его свойства не ограничиваются. Принято выделять следующие наиболее важные функции: участие в формировании и поддержании структуры костной ткани и зубов; активизация ферментных систем, обеспечивающих гемокоагуляцию и мышечное сокращение; участие в регуляции трансмембранного потенциала клетки, нервной и нервно-мышечной проводимости; поддержание сердечной деятельности; регуляция продукции и высвобождения гормонов и нейропептидов (нейромедиаторов); регуляция сосудистого тонуса; контроль всех этапов каскада свертывания крови; участие в важнейших метаболических процессах (гликогенолиз, глюконеогенез, липолиз и т. д.); функционирование в качестве «информационной» молекулы для многих ферментативных реакций; стимуляция секреторного и инкреторного процессов пищеварительных и эндокринных желез; pегуляция тонуса симпатической и парасимпатической нервной системы; биологическая сигнализация об активации всех стадий клеточного цикла и транскрипции генов; регуляция процессов внутриклеточного метаболизма; обеспечение стабильности клеточных мембран; препятствование высвобождению медиаторов аллергического воспаления; выполнение пластической роли при формировании тканевых и клеточных структур; способствование клеточной адгезии; участие в формировании кратковременной памяти и обучающих навыков; активация апоптоза и транскрипционного аппарата клеток (кофактор эндонуклеаз, участвующих в деградации ДНК при апоптозе); важна роль кальция в иммунологической активности (активация лимфоцитов, в частности, бластная трансформация в ответ на стимуляцию митогенами) [1, 2, 3].
Абсорбция кальция. Всасывается из верхних отделов тонкого кишечника, чему способствуют витамин D, аскорбиновая кислота, лактоза и кислая среда.
Всасыванию Са препятствуют избыток щавелевой кислоты, фитиновой кислоты, жиров, пищевых волокон и фосфатов. Один из важнейших механизмов поддержания уровня Са в крови — его экскреция с мочой, зависящая от фильтрации минерала и реабсорбции в почках [1].
Регуляция метаболизма кальция. Гипокальциемия, независимо от вызвавших ее причин, сопровождается снижением экскреции Са. Предполагается, что уменьшение выведения Са с мочой может происходить за счет увеличения накопления минералов в костной ткани или других тканях организма.
На регуляцию содержания Са в крови оказывают влияние: гормоны (в первую очередь, паратиреоидный гормон (ПТГ) и кальцитриол); сывороточные белки; содержание фосфатов (РО 3- 4) в сыворотке крови (реципрокные взаимоотношения).
Кальций депонируется в трабекулах костей; динамическое равновесие кальция поддерживается ПТГ и тиреокальцитонином. Pегуляция кальциевого гомеостаза является одной из наиболее сложных интегративных реакций организма человека, в осуществлении которой ведущая роль принадлежит нервной системе и железам внутренней секреции [1, 3].
Кальций и центральная нервная система (ЦНС). Гомеостаз Са имеет прямое отношение к ЦНС. Наряду с другими микро- и макроэлементами Са играет значительную роль в нейрофизиологических процессах. Еще в 1928 г. А. А. Богомолец подчеркивал исключительную важность Са в регуляции тонуса симпатической и парасимпатической нервной системы [1].
В нервной системе Са имеет значение в модуляции активности рецепторов к нейромедиаторам и нейропептидам. Повышенное высвобождение Ca способствует ишемическому повреждению нейронов вследствие вазоконстрикции и инициации каскада апоптоза [1, 3, 4]. Конкурентные взаимоотношения между различными микроэлементами (Zn, Hg, Cu, Cd) и кальцием могут определять самые разнообразные биологические эффекты и, в конечном счете, — течение неврологических процессов [4].
При рассмотрении Са на клеточном уровне необходимо выделять его участие в регуляции ионной проницаемости мембраны нейрона, генерации возбуждения.
При гипокальциемии различного генеза могут отмечаться симптомы, имеющие отношение к сфере неврологии: отклонения в поведении; онеменение и парестезии; судороги; спазмы мышц; положительные симптомы Хвостека или Труссо (гипопаратиреоз) и т. д. Нарушениям обмена Са нередко сопутствуют фебрильные судороги, пароксизмы гипоксического, метаболического или эндокринного генеза, нейрофиброматоз (1-го типа), гидроцефалия, краниостеноз и ряд других видов патологии ЦНС [1, 4]. У детей первых лет жизни ярким примером кальциопенической соматоневрологической патологии является классический (витамин D-дефицитный) рахит [2].
Существуют данные, свидетельствующие о том, что действие Са зависит от типа нервной деятельности и ее функционального состояния. На необходимость коррекции нарушений содержания Са в организме детей грудного и раннего возраста при неврологических заболеваниях указывает Е. М. Мазурина (2005) [2].
Следует помнить, что избыточное накопление в организме Са может привести к нейротоксичности, угрозе патологической кальцификации стенок сосудов и тканей организма [3, 4].
Потребность в кальции. Ha первом году жизни она составляет (по разным данным) от 350 мг до 1000 мг/сут, на втором — 370–1000 мг/сут, на третьем — 300–1000 мг/сут. У детей более старшего возраста и взрослых она возрастает до 1000–1500 мг/сут [1, 2]. Внимания заслуживает то обстоятельство, что в разных странах мира рекомендации по суточной потребности в Са2+ значительно отличаются. По-видимому, это объясняется особенностями разных регионов (климато-географическими, экологическими и др.).
Алиментарное поступление Са имеет огромное значение в любом возрасте. J. C. Leblanc et al. (2005) изучены паттерны диетического потребления 18 элементов во Франции, a R. B. Ervin et al. (2004) — отдельных минеральных веществ в США [5, 6]. Применительно к Са они признаны неудовлетоворительными в обеих странах.
Нормы содержания кальция в организме. Считается, что около 70% Са экскретируется с калом, 10% — c мочой, а ретенция элемента составляет 15–25% (в зависимости от темпов роста).
Сывороточное содержание Са (в норме) равняется 9–11 мг%, причем 50–60% — в ионизированной форме. У здоровых детей независимо от возраста в сыворотке крови содержится 4,9–5,5 мг% (1,22–1,37 ммоль/л) ионизированного Ca, исходя их данных, полученных с использованием ион-селективных электродов. Экскреция Са с калом (при следовании обычной диете) составляет менее 140 ммоль/сутки (560 мг/сутки). Определяется прямая зависимость содержания Са в кале от особенностей диеты.
Содержание Са в моче также находится в прямой зависимости от количества алиментарно потребляемого элемента. В частности, при нормальной диете суточная экскреция равняется 2,5–7,5 ммоль/сут (100–300 мг/сут, 5–15 мЭкв/сут). При потреблении Са на уровне менее 200 мг/сут — 0,33–4,5 ммоль/сут (13–180 мг/сут), 200–600 мг/сут — 1,25–5,0 ммоль/сут (50–200 мг/сут), 1000 мг/сут — 7,5 ммоль/сут (до 300 мг/сут) [1, 2].
Снижение содержания кальция в физиологических средах организма. Наиболее значимо снижение Са в сыворотке крови. В этой физиологической жидкости Са представлен тремя следующими формами: связанный с белками (недиффундирующий — 30–55%); хелатированный (диффундирующий, но неионизированный — около 15%); ионизированный Са (около 30–55%) [3].
Физиологическое снижение содержания Са в крови может отмечаться при повышенной утилизации углеводов или назначении инсулина. Патологическое снижение содержания Са свойственно следующим клиническим ситуациям: гипопаратиреоидизм (следствие хирургического вмешательства в области паращитовидных желез); псевдогипопаратиреоидизм; дефицит витамина D; стеаторея (сочетанные нарушения абсорбции витамина D, Ca и РО 3- 4); нефрит (снижение неионизированной фракции Са, переносимой белками сыворотки, по-видимому вследствие потери Са с мочой); болезни почек с ретенцией фосфатов; острый панкреатит; внутривенное введение солей Mg, оксалатов или цитратов; остеопороз у пожилых людей (нижняя граница нормы); неонатальная гипокальциемия (первый день жизни — вследствие низкой массы тела при рождении, острой интранатальной асфиксии, наличия у матери сахарного диабета, гиперпаратиреоза или нелеченой целиакии; недоразвития плаценты, гестоза, оперативных родов посредством кесарева сечения, при заменных переливаниях крови; 5–10 день — вследствие гиперфосфатемии, вызванной потреблением коровьего молока или малоадаптированных смесей на его основе); гипомагниемия; длительный прием антиконвульсантов (обычно при эпилепсии); состояние после удаления щитовидной железы; болезнь Педжета — при лечении кальцитонином. Особое внимание в отечественной и зарубежной литературе различных лет уделяется кальциопеническим состояниям при остеопорозе и сходных с ним видах костной патологии [1].
Снижение содержания Са в кале обнаруживается в следующих случаях: остеомаляция, успешно вылеченная препаратами витамина D; гипервитаминоз D; низкое содержание фосфора в рационе питания; саркоидоз Бека (в некоторых случаях).
В моче снижение содержания Са возможно при низком потреблении этого макроэлемента с пищей, а кроме того, нередко отмечается на поздних сроках беременности.
Концентрация Са в спинномозговой жидкости (СМЖ) составляет около 1/2 от сывороточного содержания. Изменения в содержании Са в СМЖ невелики, а их регистрация не имеет большого значения для диагностики различных патологических состояний. Уровень Са в СМЖ может снижаться у некоторых пациентов с эпилепсией, длительно получающих терапию фенитоином и другими аниэпилептическими препаратами (АЭП). Практически все известные к настоящему времени АЭП обладают Са-изгоняющими свойствами. Дети грудного и раннего возраста, страдающие эпилепсией, наиболее подвержены риску гипокальциемии [1].
Методы коррекции кальциопенических состояний. Если при острых нарушениях концентрации Са в сыворотке крови тактика лечения уже давно разработана и является почти хрестоматийной, то в области профилактики и коррекции умеренной гипокальциемии до сих пор отмечается определенный пробел.
В различных областях медицины нередко имеет место эмпирический подход к данной проблеме. Попытки компенсировать индуцированный приемом антиконвульсантов дефицит Са за счет приема антиэпилептических препаратов, в состав которых включены соли кальция, в подавляющем большинстве случаев малоэффективны. Так, одна 300-миллиграммовая таблетка препарата Конвульсофин содержит всего 33 мг кальциевой соли, а в составе Паглюферала обнаруживается 250 мг глюконата Са (в составе глюферала — 200 мг). Указанные количества макроэлемента явно недостаточны для нивелирования Са-изгоняющих эффектов этих антиэпилептических средств.
Широкая распространенность, мультифакториальность и потенциальная предотвратимость кальциопенических состояний предполагают необходимость совершенствования методов их профилактики и коррекции. J.-Y. Reginster et al. (2002) подчеркивает влияние ежедневного приема Са и витамина D на секрецию гормонов паращитовидной железой [7]. Сомнения относительно существующих рекомендаций по профилактическому приему препаратов Са и витамина D высказывали A. Prentice (2002) и J. A. Amorim Cruz (2003) [8, 9]. H. L. Newmark et al. (2004) считают необходимым добавление Са и кальциферола в зерновые продукты промышленного производства [10]. В отличие от профилактики кальциопенических состояний, в их коррекции диета малоэффективна. Поэтому для коррекции дефицита Са в организме используются препараты, содержащие этот макроэлемент [1, 2].
Препараты кальция, используемые в медицине, и показания к их применению. В используемых справочниках лекарственных средств приводятся следующие основные формы кальция: хлорид, глюконат, лактат, карбонат и цитрат, хотя данный макроэлемент может быть представлен и другими соединениями (кальция фолинат, ацетат, g-гидроксибутират, глицерофосфат, глутаминат, добезилат, пангамат, пантотенат, тринатрия пентенат, фосфат и др.) [11, 12, 13].
В числе показаний к назначению основных перечисленных препаратов Са фигурируют следующие: недостаточная функция паращитовидных желез, сопровождающаяся тетанией или спазмофилией; усиленное выделение Са из организма (при длительной обездвиженности больных, синдромах мальабсорбции или приеме АЭП); аллергические заболевания; уменьшение проницаемости сосудов; кожные заболевания; паренхиматозный гепатит; токсические поражения печени; нефрит; гиперкалиемическая форма пароксизмальной миоплегии; хроническая почечная недостаточность; остеопороз [11, 12, 13].
В литературе последних лет представлены и другие показания к применению препаратов Са: синдром хронической усталости; сахарный диабет; артериальная гипертензия у детей с солевой чувствительностью. Помимо этого, кальций может назначаться для повышения свертываемости крови (как гемостатическое средство). В качестве показаний к использованию препаратов Са необходимо привести различные виды рахита (витамин D-зависимый, витамин D-резистентный, витамин D-дефицитный, остеопения маловесных детей и т. д.) [1].
К сожалению, даже при продолжительном назначении препаратов, обладающих Са-изгоняющим действием, а также других лекарственных средств, индуцирующих гипокальциемию, рутинной коррекции уровня кальция обычно не проводится, а в существующих рекомендациях подобной процедуры не предусмотрено.
Положительный эффект препаратов кальция проявляется только при индивидуальном подборе их дозировки. При назначении всегда необходимо учитывать утилизацию (усвоение) данного макроэлемента, выраженную в процентах от назначаемого количества. В частности, для глюконата, лактата и хлорида кальция она составляет соответственно 9%, 13% и 27%. Для карбоната и цитрата кальция характерны более высокие показатели всасывания из кишечника. B. W. Downs et al. (2005) cообщают о высокой биологической эффективности новой соли на основе кальций-калиевого соединения гидроксицитрусовой кислоты [14].
Литература
- Николаев А. С., Мазурина Е. М., Кузнецова Г. В. и др. Физиологическое и патофизиологическое значение метаболизма кальция в детском возрасте // Вопр. практ. педиатрии. 2006 Т. 1. № 2. С. 57–65.
- Мазурина Е. М. Нарушения обмена кальция у детей первых трех лет жизни при неврологической патологии // Автореф. дис. канд. мед. наук. М. 2005. 26 с.
- Громова О. А., Кудрин А. В. Нейрохимия макро- и микроэлементов. Новые подходы к фармакотерапии. М.: Алев-В. 2001. 272 с.
- Кудрин А. В., Громова О. А. Микроэлементы в неврологии. М.: ГЭОТАР-Медиа. 2006. 304 с.
- Leblanc J. C., Guerin T., Noel L. et al. Dietary exposure estimates of 18 elements from the 1 st French Total Diet Study // Food Addit. Contam. 2005; 22: 624–641.
- Ervin R. B., Wang C.-Y., Wright J. D. et al. Dietary intake of selected minerals for United States population: 1999–2000 // Advance Data. 2004; № 341: 1–3.
- Reginster J.-Y., Zegels B., Lejeune E. et al. Influence of daily regimen calcium and Vitamin D supplementation on parathyroid hormone secretion // Calcif. Tissue Int. 2002; 70: 78–82.
- Prentice A. What are the dietary requirements for calcium and vitamin D? // Calcif. Tissue Int. 2002; 70: 83–88.
- Amorim Cruz J. A. Nutrition and osteoporosis: facts and uncertainties about calcium and vitamin D recommendations // Forum Nutr. 2003; 56: 178–181.
- Newmark H. L., Heaney R. P., Lachance P. A. Should calcium and vitamin D be added to the current enrichment program for cereal-grain products? // Am. J. Clin. Nutr. 2004;80: 264–270.
- Регистр лекарственных средств России «Энциклопедия лекарств». Изд-е 15-е. М.: РЛС. 2007.
- Справочник Видаль. Лекарственные препараты в России. Изд-е 13-е. М.: АстраФармСервис. 2007.
- Федеральное руководство по использованию лекарственных средств. Вып. VIII. М.: ЭХО, 2007.
- Downs B. W., Bagchi M., Subbaraju G. V. et al. Bioefficacy of a novel calcium-potassium salt of (-)-hydroxycitric acid // Mutat. Res. 2005; 579: 149–162.
В. М. Студеникин, доктор медицинских наук, профессор
Э. М. Курбайтаева
НЦЗД РАМН, Москва
Источник