- Синдром Кушинга: как поставить диагноз
- В каких случаях врач общей практики должен заподозрить синдром Кушинга? Как подтвердить диагноз? Нужно ли отменять короткие курсы экзогенных кортикостероидов постепенно?
- Таблица 1. Симптомы синдрома Кушинга (в порядке частоты встречаемости)
- Случай из практики
- Болезнь Иценко-Кушинга
- Этиология и патогенез
- Клиническая картина
- Диагноз и дифференциальный диагноз
- Лечение БИК
Синдром Кушинга: как поставить диагноз
В каких случаях врач общей практики должен заподозрить синдром Кушинга? Как подтвердить диагноз? Нужно ли отменять короткие курсы экзогенных кортикостероидов постепенно? Рисунок 1. Плетора и лунообразность лица, присущие синдрому К
В каких случаях врач общей практики должен заподозрить синдром Кушинга?
Как подтвердить диагноз?
Нужно ли отменять короткие курсы экзогенных кортикостероидов постепенно?
 |
| Рисунок 1. Плетора и лунообразность лица, присущие синдрому Кушинга |
Есть прекрасное определение, позволяющее различить синдром Кушинга (СК) и болезнь Кушинга (БК). Описанный впервые Гарви Кушингом в 1912 году, синдром Кушинга объединяет симптомы, вызываемые постоянно повышенным уровнем свободного кортизола в крови. Понятие «болезнь Кушинга» оставлено за особым гипофизарным АКТГ-зависимым подтипом синдрома.
Ярко выраженный СК не представляет особых диагностических трудностей, но заболевание с умеренными проявлениями может вызвать у врача общей практики ряд проблем. Диагноз ставится клинически, а подтверждается данными лабораторных исследований.
Большинство случаев СК имеет ятрогенное происхождение и обусловлено длительным приемом преднизолона, дексаметазона или других кортикостероидов. К развитию клинических проявлений заболевания приводит ежедневное применение кортикостероидов в дозах, превышающих эквивалент 7,5 мг преднизолона.
Детям для развития кушингоидных черт достаточно меньших доз.
Хотя СК встречается относительно редко, любой врач общей практики сталкивается с его ятрогенными случаями, вызванными длительным приемом кортикостероидов по поводу таких распространенных заболеваний, как, например, ревматоидный артрит.
Таблица 1. Симптомы синдрома Кушинга (в порядке частоты встречаемости)
БК — наиболее распространенная причина неятрогенного СК (70%); оставшиеся 30% приходятся на случаи эктопической секреции АКТГ и надпочечниковое происхождение болезни (АКТГ-независимый СК).
Клиническая картина. Симптомы СК (см. табл. 1) могут, в зависимости от причины, развиваться остро или исподволь в течение нескольких лет.
Как правило, симптомы неспецифичны и включают сонливость, депрессию, увеличение веса, жажду, полиурию, слабость, легкость появления синяков и гирсутизм [1].
К классическим признакам СК у взрослых относятся «лунообразное» лицо (рис. 1), центральное ожирение (рис. 2), плетора лица, буйволиный горб, надключичные жировые подушечки и периферические отеки. У детей самым ранним признаком служит задержка роста; нормальная кривая роста фактически исключает СК [2].
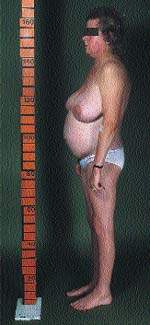 |
| Рисунок 2. Типичная конституция пациента с СК. Обратите внимание на центральное ожирение и относительно тонкие руки и ноги, что вызвано проксимальной миопатией |
Конечно, ожирение в общей практике встречается часто, и трудность состоит в том, чтобы отличить общее ожирение от центрального. Главным признаком является накопление жира в центральной части тела с одновременной его потерей на бедрах, ягодицах и руках. Атрофия поперечнополосатых мышц обусловливает внешний вид пациента, подобный «лимону на палочках».
Еще одним клиническим признаком СК служат истончение кожи и ломкость капилляров, приводящие к легкому и часто спонтанному образованию синяков. Таким больным присущи кожные инфекции, например отрубевидный лишай, молочница и онихомикоз, причем кожные повреждения заживают с трудом. Почти всегда можно обнаружить абдоминальные стрии, развивающиеся вторично за счет центрального ожирения (рис. 3).
Больные могут страдать от гирсутизма вследствие избыточного образования надпочечниковых андрогенов под воздействием повышенного АКТГ.
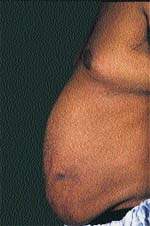 |
| Рисунок 3. Стрии живота у мужчины с СК |
Метаболические изменения, вызываемые повышенным уровнем кортизола, приводят к развитию сахарного диабета, гипертензии и дислипидемии. С длительным повышением циркулирующего в крови кортизола связано также уменьшение минеральной плотности костей и остеопороз.
Биохимическое подтверждение. Важно исключить использование кортикостероидных препаратов и злоупотребление алкоголем («алкогольный псевдо-Кушинг»).
Применение стероидных ингаляторов (например, беклометазона в дозе 200 мкг каждые 6 часов в течение более чем трех месяцев) и других местных стероидных препаратов может приводить к значительному системному всасыванию и развитию клинических проявлений СК с подавлением гипоталамо-гипофизарно-адреналовой оси.
Если пациент не принимает подобных лекарств, первым шагом будет подтверждение избытка кортизола путем определения свободного кортизола мочи (СКМ) в двух суточных пробах [3].
Следующая задача — показать, что эндогенная секреция кортизола не подавлена экзогенными глюкокортикоидами. Для этого проводится ночная дексаметазоновая проба (ДП): в 11 часов вечера пациент принимает 1 мг дексаметазона, а на следующее утро между 8 и 9 часами берется проба крови на кортизол. СК предполагается в том случае, если уровень кортизола не упал ниже 50 нмоль/л. Однако вследствие низкой специфичности теста могут быть ложноположительные результаты.
Направление к специалисту. При подозрении на СК необходимо сразу же направить пациента к эндокринологу. После направления, как правило, дважды проводится определение СКМ и выполняется более специфическое исследование — проба с дексаметазоном в низкой дозе (ДПНД) [4]. Пациент принимает по 0,5 мг дексаметазона восемь раз каждые 6 часов. Отсутствие падения кортизола ниже 50 нмоль/л в 9 часов утра по окончании ДПНД указывает на СК.
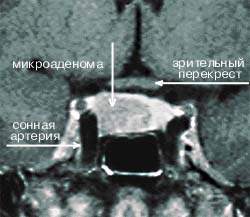 |
| Рисунок 4. МР-томограмма гипофиза, на которой видна правосторонняя микроаденома, секретирующая АКТГ (гипофиз-зависимая болезнь Кушинга) |
Определение СКМ дает нормальные результаты практически постоянно, если у пациента циклический СК (то есть активность заболевания нарастает и падает в течение недель или месяцев), поэтому данное исследование считается низкочувствительным. Более важная проба — ДПНД, и при обнаружении отклонений от нормы пациента следует направить на дальнейшее обследование.
Амбулаторные исследования включают изучение суточного ритма кортизола (рис. 5), дексаметазоновую пробу с высокой дозой [5] (ДПВД, рис. 6) и определение кортикотропин-рилизинг гормона (КРГ). Подтверждение гипофиз-зависимого заболевания основывается на заборе крови из нижнего каменистого синуса для определения в ней уровня АКТГ и последующего введения КРГ [6, 7]. Как правило, требуется визуализация: компьютерное сканирование надпочечников, чтобы дифференцировать надпочечниковое и АКТГ-зависимое состояние; МР-томография гипофиза (рис. 4); компьютерное сканирование грудной клетки и брюшной полости при подозрении на эктопическую секрецию АКТГ.
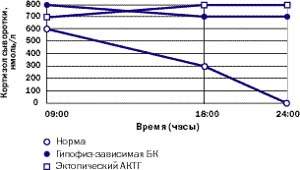 |
| Рисунок 5. Так выглядит типичный суточный ритм кортизола у здорового человека, пациента с БК и пациента с эктопическим СК |
Лечение СК зависит от причины заболевания. Методом выбора при БК служит селективная транссфеноидальная микроаденомэктомия: излечения удается добиться в 80% случаев (эффективным лечение считается тогда, когда наличие кортизола через 24-48 часов после операции не обнаруживается) [8].
При успешном исходе операции по поводу БК пациенту понадобится заместительный курс гидрокортизона, пока не восстановится его собственная гипоталамо-гипофизарно-надпочечниковая (ГГН) функция. Как правило, достаточно 20 мг гидрокортизона утром и 10 мг — в 6 часов вечера.
В случае обнаружения аденомы надпочечников показана односторонняя адреналэктомия. Железа с другой стороны оказывается атрофичной (по принципу обратной связи) в результате длительного подавления секрецией АКТГ, поэтому пациенту также понадобится заместительная терапия гидрокортизоном вплоть до восстановления ГГН.
Эктопические АКТГ-секретирующие опухоли (например, карциноиды бронхов или тимуса) требуют удаления. После операции вновь проводится гидрокортизоновое прикрытие. Процесс включения ГГН может занять несколько месяцев. При отсутствии эффекта от операции проводят облучение гипофиза из внешнего источника (4500 Гр в 25 сериях).
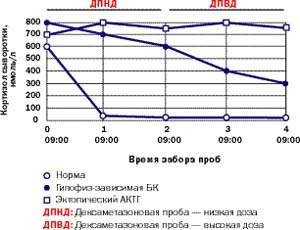 |
| Рисунок 6. Типичные реакции кортизола на дексаметазоновую супрессию низкими (0,5 мг каждые 6 часов в течение 48 часов) и высокими дозами (2 мг каждые 6 часов в течение 48 часов) у здорового человека, пациента с БК и пациента с эктопическим СК |
Если есть противопоказания к проведению оперативного вмешательства, связанные непосредственно с СК, снизить уровень кортизола можно кетоконазолом (начиная с 200 мг). Дозы препаратов подбирают индивидуально, ориентируясь на средний уровень кортизола 200-300 нмоль/л.
После медикаментозного лечения пациент может успешно перенести операцию. При отказе от операции остается возможность длительного лечения кетоконазолом, проводящимся под наблюдением госпитального эндокринолога.
Двусторонняя адреналэктомия проводится только в самых тяжелых случаях, когда безуспешно испробованы все остальные методы. Она неизбежно приводит к необходимости пожизненной заместительной терапии кортикостероидами и минералокортикоидами.
Ведение больных с СК. Самая распространенная причина СК — ятрогенная, особенно если доза принимаемых внутрь стероидов превышает эквивалент 7,5 мг преднизолона у взрослых.
Для профилактики остеопороза пациентам, принимающим стероиды более шести месяцев, назначают бисфосфонаты.
Решение о снижении дозы стероида следует принимать, проконсультировавшись с соответствующим специалистом. Экзогенные стероиды, назначаемые коротким курсом (менее 6 недель), редко вызывают клинически значимую надпочечниковую супрессию, поэтому их можно резко отменять.
При подозрении на неятрогенный СК измерение СКМ и ночная ДП могут помочь в подтверждении этого диагноза (vide supra). Но пациента, у которого обнаружены клинические признаки неятрогенного СК (см. табл.), рекомендуется обязательно направить к эндокринологу.
Случай из практики
Друзья и члены семьи 24-летней женщины заметили, что она полнеет и как бы «сама не своя». Она часто находилась в подавленном настроении и с трудом могла сосредоточиться на своей работе.
Врач общей практики, к которому она обратилась, отметил «лунообразное лицо» и умеренный гирсутизм. Артериальное давление, прежде нормальное, составляло 150/100 мм рт. ст.
Она была срочно направлена к эндокринологу по месту жительства. При обследовании выявлена повышенная суточная экскреция с мочой свободного кортизола и потеря суточного кортизольного ритма. Дексаметазоновая проба не выявила супрессии ни при низкой, ни при высокой дозе дексаметазона; реакция кортизола на экзогенный КРГ оказалась плоской.
МРТ-скан гипофиза был нормальным, а при компьютерном сканировании брюшной полости обнаружены утолщенные гиперплазированные надпочечники, характерные для АКТГ-зависимости. Пигментация ладонных складок также подтверждала повышение продукции АКТГ.
Был поставлен клинический и биохимический диагноз эктопического АКТГ-синдрома, и больную отправили в соответствующий центр. Компьютерное сканирование грудной клетки выявило опухоль размером 1 см в верхушке правого легкого, которая была удалена под прикрытием гидрокортизона.
После четырехмесячного курса преднизолона (5 мг на ночь и 2,5 мг днем) наблюдалось восстановление ее ГГН-оси, и стероиды постепенно отменили. Тело приобрело нормальные формы в течение 6 месяцев, восстановилась супрессорная активность дексаметазона.
Источник
Болезнь Иценко-Кушинга
Болезнь Иценко-Кушинга (БИК) — это тяжелое многосимптомное заболевание гипоталамо-гипофизарного генеза, протекающее с проявлениями клинической картины гиперкортицизма, обусловленное наличием опухоли гипофиза или его гиперплазии и характеризующееся повыше
Болезнь Иценко-Кушинга (БИК) — это тяжелое многосимптомное заболевание гипоталамо-гипофизарного генеза, протекающее с проявлениями клинической картины гиперкортицизма, обусловленное наличием опухоли гипофиза или его гиперплазии и характеризующееся повышенной секрецией адренокортикотропного гормона (АКТГ), увеличением продукции гормонов корой надпочечников.
Считается, что при БИК у 85% больных имеется аденома передней доли гипофиза (кортикотропинома), что, по современным представлениям, является первопричиной заболевания. Кортикотропиномы характеризуются небольшими размерами. Это так называемые микроаденомы, располагающиеся внутри турецкого седла. Макроаденомы встречаются при БИК значительно реже. У 15% пациентов с БИК находят диффузную или узелковую гиперплазию АКТГ-продуцирующих клеток (кортикотрофов). Редко у больных БИК обнаруживается первичное «пустое» турецкое седло, либо никаких изменений в этой области на КТ и МРТ не выявляется.
Этиология и патогенез
Причина болезни Иценко-Кушинга точно не установлена. БИК чаще встречается у женщин, редко диагностируется в детском и пожилом возрасте. У женщин заболевание развивается в возрасте от 20 до 40 лет, есть зависимость от беременности и родов, а также от травм головного мозга и нейроинфекций. У подростков БИК часто начинается в период полового созревания.
Установлено, что большинство таких опухолей по своей природе являются моноклональными, что свидетельствует о наличии генных мутаций в исходных клетках.
В онкогенезе АКТГ-продуцирующих опухолей гипофиза важная роль принадлежит аномальной чувствительности гипофиза к гипоталамическим факторам. Усиление стимулирующего действия нейрогормонов или ослабление ингибирующих сигналов имеет значение в процессах образования и роста опухоли гипофиза. Нарушение действия ингибирующих нейрогормонов, таких, как соматостатин и допамин, может сопровождаться усилением деятельности стимулирующих нейрогормонов. Кроме того, имеются данные, свидетельствующие о том, что неконтролируемая клеточная пролиферация опухолей гипофиза может стать результатом нарушения действия ростовых факторов.
Потенциальным механизмом развития кортикотропином может стать спонтанная мутация генов рецепторов КРГ или вазопрессина.
Автономная секреция АКТГ опухолью приводит к гиперфункции коры надпочечников. Поэтому основная роль в патогенезе БИК отводится повышению функции коры надпочечников. При АКТГ-зависимой форме болезни Иценко-Кушинга имеет место повышение функциональной активности всех трех зон коры надпочечников: изменения в клетках пучковой зоны ведут к гиперсекреции кортизола, клубочковой — к повышению альдостерона и сетчатой — к усилению синтеза дегидроэпиандростерона (ДГЭС).
Для болезни Иценко-Кушинга характерно не только повышение функционального состояния коры надпочечников, но и увеличение их размеров. В 20% случаев на фоне гиперплазии надпочечников обнаруживаются вторичные аденомы небольших размеров (1–3 см).
При кортикотропиномах кроме гиперсекреции АКТГ наблюдается нарушение функции гипофизарных гормонов. Так, базальная секреция пролактина у больных с БИК нормальная или незначительно повышена. Соматотропная функция гипофиза у больных с кортикотропиномами снижена. Стимулирующие тесты с инсулиновой гипогликемией, аргинином и L-Допа показали снижение резервов СТГ при болезни Иценко-Кушинга. Уровень гонадотропных гормонов (ЛГ, ФСГ) у больных снижен. Это обусловлено прямым супрессивным действием избытка эндогенных кортикостероидов на секрецию рилизинг-гормонов гипоталамусом.
Клиническая картина
Клиническая картина болезни Иценко-Кушинга обусловлена избыточной секрецией кортикостероидов и, в первую очередь, глюкокортикоидов. Увеличение массы тела характеризуется своеобразным («кушингоидный» тип ожирения) неравномерным перераспределением подкожно-жировой клетчатки в области плечевого пояса, надключичных пространств, в области шейных позвонков («климактерический горбик»), живота, при сравнительно тонких конечностях. Лицо становится круглым («лунообразное»), щеки — багрово-красного цвета («матронизм»). Кроме того, при БИК наблюдаются трофические изменения кожи. При осмотре кожные покровы истонченные, сухие с наклонностью к гиперкератозу и имеют багрово-цианотичную окраску. На бедрах, груди, плечах, животе появляются своеобразные полосы растяжения (стрии) красно-фиолетового цвета. Характер стрий — «минус» ткань. Эти стрии отличаются от бледных или розовых полос растяжения, которые встречаются при ожирении, в период беременности или родов. Появление стрий при БИК связано с нарушением белкового обмена (катаболизм белков), в результате чего кожа истончается. Наличие гематом при незначительных травмах является следствием повышенной ломкости капилляров и истончения кожи. Наряду с этим отмечается гиперпигментация кожных покровов в местах трения (шея, локтевые суставы, подмышечные впадины). У женщин часто наблюдается повышенное оволосение (гирсутизм) на лице (усы, борода, бакенбарды) и груди. Половые расстройства в виде вторичного гипогонадизма являются одним из ранних симптомов при БИК.
В симптомокомплексе БИК наиболее существенным в клинической картине заболевания является поражение сердечно-сосудистой системы. Сочетание артериальной гипертонии с нарушениями метаболизма в сердечной мышце приводит к хронической недостаточности кровообращения и другим изменениям со стороны сердечно-сосудистой системы. Миопатия часто является характерным симптомом гиперкортицизма, который выражается дистрофическими изменениями мышц и гипокалиемией. Атрофические процессы, затрагивающие поперечно-полосатую и мышечную систему, особенно заметны в верхних и нижних конечностях («истончение» рук и ног). Атрофия мышц передней брюшной стенки ведет к увеличению живота.
Содержание калия в эритроцитах и мышечной ткани (в том числе и в миокарде) значительно снижено. Нарушения электролитного обмена (гипокалиемия и гипернатриемия) лежат в основе электролитно-стероидной кардиопатии и миопатии. При БИК нарушения углеводного обмена различной степени выраженности наблюдаются у большого числа больных. При этом у 70–80% пациентов выявляется нарушенная толерантность к глюкозе, а у остальных — сахарный диабет 2 типа. Клинические проявления диабета характеризуются гиперинсулинемией, инсулинорезистентностью и отсутствием склонности к кетоацидозу. Диабет имеет, как правило, благоприятное течение, и для его компенсации достаточно назначения диеты и пероральных сахароснижающих препаратов.
Вторичный иммунодефицит проявляется гнойничковыми (акне) или грибковыми поражениями кожи и ногтевых пластин, трофическими язвами голеней, длительным периодом заживления послеоперационных ран, хроническим и трудно поддающимся лечению пиелонефритом. Энцефалопатия в виде изменения вегетативной нервной системы при БИК ярко выражена и многообразна. Синдром вегетативной дистонии характеризуется эмоционально-личностными сдвигами: от нарушения настроения, сна и до выраженных психозов.
Системный остеопороз представляет собой распространенное и нередко тяжело протекающее проявление гиперкортицизма при БИК в любом возрасте. Остеопороз является причиной болей в позвоночнике, часто приводит к снижению высоты тел позвонков и спонтанным переломам ребер и позвонков.
В зависимости от выраженности гиперкортицизма и формирования клинических симптомов различают несколько степеней тяжести БИК. Легкая форма характеризуется умеренной выраженностью симптомов заболевания; средняя — выраженностью всех симптомов при отсутствии осложнений. Тяжелая форма отличается выраженностью симптомов и наличием осложнений (сердечно-легочная недостаточность, стероидный диабет, прогрессирующая миопатия, патологические переломы, тяжелые психические расстройства). В зависимости от скорости нарастания клинической симптоматики различают быстропрогрессирующее (три–шесть месяцев) и торпидное течение заболевания, которое проявляется сравнительно медленным (от одного года и более) развитием гиперкортицизма.
При подозрении на БИК необходимо проверить, имеется ли у больного гиперкортицизм, затем провести дифференциальную диагностику форм гиперкортицизма (БИК, АКТГ-эктопированный синдром, синдром Иценко-Кушинга), сходных синдромов (ожирение, метаболический синдром, пубертатно-юношеский диспитуитаризм, алкогольное поражение печени) и установить локализацию основного патологического процесса.
Диагноз и дифференциальный диагноз
При подозрении на болезнь Иценко-Кушинга после сбора анамнеза и клинического осмотра у всех больных с помощью методов лабораторной диагностики необходимо подтвердить наличие гиперкортицизма. На первом этапе выявляется повышенная продукция кортизола. С этой целью определяют суточный ритм секреции кортизола в плазме крови утром (8.00-9.00) и вечером (23.00-24.00). Для больных БИК характерно повышение утреннего уровня кортизола в плазме крови, а также нарушение ритма секреции кортизола, т. е. в ночное или вечернее время уровень кортизола остается повышенным. Определение суточной экскреции свободного кортизола в моче является также необходимым методом лабораторной диагностики для подтверждения гиперкортицизма. Уровень свободного кортизола в моче определяется РИА-методом. Для здоровых лиц содержание кортизола колеблется от 120 до 400 нмоль/с. У больных с БИК экскреция кортизола в суточной моче повышена.
В сомнительных случаях для дифференциальной диагностики между патологическим эндогенным и функциональным гиперкортицизмом проводится малая проба с дексаметазоном. Она основана на подавлении продукции эндогенного АКТГ высокими концентрациями кортикостероидов по принципу обратной связи. Если секреция кортизола не снижается на 50% и более от исходного уровня, это свидетельствует о наличии гиперкортицизма.
Таким образом проводится дифференциальная диагностика патологического и функционального гиперкортицизма.
При выявлении повышенной продукции кортизола необходимо провести следующий этап обследования — дифференциальную диагностику между формами эндогенного патологического гиперкортицизма (БИК, СИК, АКТГ-эктопированный синдром), болезнью Иценко-Кушинга, АКТГ-эктопированным синдромом и синдромом Иценко-Кушинга. Этот этап обследования включает в себя определение ритма секреции АКТГ в плазме крови и проведение большой пробы с дексаметазоном.
Для БИК характерны нормальное или повышенное (до 100 –200 пг/мл) утреннее содержание АКТГ и отсутствие его снижения в ночное время. При АКТГ-эктопированном синдроме секреция АКТГ повышена и может колебаться от 100 до 200 пг/мл и выше, и при этом также отсутствует ритм его секреции. При АКТГ-независимых формах гиперкортицизма (синдром Иценко-Кушинга, макро- или микроузелковая дисплазия надпочечников) утреннее содержание АКТГ, как правило, снижено при отсутствии ритма его секреции.
Большая проба с дексаметазоном в настоящее время широко применяется для диагностики патологического гиперкортицизма.
При БИК, как правило, происходит снижение уровня кортизола на 50% и более от исходного уровня, тогда как при АКТГ-эктопированном синдроме это наблюдается лишь в редких случаях. При АКТГ-независимых формах синдрома Иценко-Кушинга указанного снижения уровня кортизола также не отмечается, так как продукция гормонов опухолью не зависит от гипоталамо-гипофизарных взаимоотношений.
В зарубежной литературе для диагностики БИК широко используется проба с кортиколиберином (КРГ). Введение КРГ приводит к стимуляции секреции АКТГ у больных БИК. При БИК содержание АКТГ в плазме крови увеличивается более чем на 50%, а уровень кортизола на 20% от исходного. При АКТГ-эктопированном синдроме концентрация АКТГ практически не меняется.
Методы топической диагностики при БИК используются для выявления патологического процесса в гипоталамо-гипофизарной области и надпочечниках (диагностика микро- или макроаденомы гипофиза и гиперплазии надпочечников). К таким методам следует отнести рентгенографию костей черепа, КТ или МРТ головного мозга, УЗИ надпочечников и КТ или МРТ надпочечников.
Визуализация кортикотропином представляет собой наиболее диагностически сложную задачу, так как размер их бывает очень небольшой (2–10 мм). При этом в поликлинических условиях в первую очередь проводится рентгенография костей черепа (боковая рентгеновская краниограмма) с целью выявления рентгенологических признаков аденомы гипофиза. Существуют следующие явные или косвенные признаки аденомы гипофиза: изменение формы и увеличение размеров турецкого седла, локальный или тотальный остеопороз спинки седла, «двухконтурность» дна, выпрямление передних и задних клиновидных отростков.
В настоящее время магнитно-резонансную томографию и/или компьютерно-томографическое исследование принято считать основными методами диагностики аденомы гипофиза. Методом выбора при визуализации кортикотропином является МРТ или МРТ с контрастированием. Преимуществами этого метода, по сравнению с КТ, можно считать лучшую выявляемость микроаденомы гипофиза и синдрома «пустого» турецкого седла, который может встречаться при болезни Иценко-Кушинга.
Лечение БИК
Лечение БИК должно быть направлено на исчезновение основных клинических симптомов гиперкортицизма, стойкую нормализацию уровня АКТГ и кортизола в плазме крови с восстановлением их суточного ритма и нормализацию кортизола в суточной моче.
Все методы лечения болезни Иценко-Кушинга, которые используются в настоящее время, можно разделить на четыре группы: нейрохирургическое (транссфеноидальная аденомэктомия), лучевое (протонотерапия, γ-терапия), комбинированное (лучевая терапия в сочетании с односторонней или двусторонней адреналэктомией) и медикаментозное лечение. Из них основные виды — нейрохирургическое, лучевое и комбинированное; медикаментозная терапия применяется как дополнение к ним.
В настоящее время во всем мире предпочтение отдается транссфеноидальной аденомэктомии. Этот метод позволяет добиться быстрой ремиссии заболевания с восстановлением гипоталамо-гипофизарных взаимоотношений у 84–95% больных уже через шесть месяцев. Показанием к аденомэктомии служит четко локализованная (на основании данных КТ или МРТ) опухоль гипофиза. Аденомэктомия может быть проведена повторно, если имеется подтвержденный на КТ или МРТ продолженный рост аденомы гипофиза, в любые сроки после операции. Этот метод характеризуется минимальным количеством осложнений (около 2–3%) и очень низкой послеоперационной летальностью (0–1%).
Адреналэктомия — тотальная одно- или двусторонняя — применяется только в комбинации с лучевой терапией. При крайне тяжелой и прогрессирующей форме заболевания осуществляется двусторонняя адреналэктомия в сочетании с лучевой терапией для профилактики развития синдрома Нельсона (прогрессирование роста аденомы гипофиза при отсутствии надпочечников). После тотальной двусторонней адреналэктомии пациент пожизненно получает заместительную гормональную терапию.
Из методов лучевой терапии в настоящее время используются протонное облучение и дистанционная γ-терапия, при этом предпочтение отдается протонотерапии. Протонное облучение наиболее эффективно в связи с тем, что энергия выделяется в области аденомы гипофиза и при этом окружающие ткани затрагиваются минимально. Абсолютным противопоказанием к проведению протонотерапии является опухоль гипофиза более 15 мм в диаметре и супраселлярное ее распространение с дефектом полей зрения.
γ-терапия как самостоятельный метод лечения применяется в последнее время редко и только при невозможности проведения аденомэктомии или протонотерапии. Эффективность действия этого метода следует оценивать не раньше, чем через 12–15 и более месяцев после проведения курса облучения.
Медикаментозная терапия при БИК должна использоваться в следующих случаях: подготовка пациента к проведению лечения основным методом, облегчение течения послеоперационного периода и сокращение срока наступления ремиссии заболевания. Фармакологические препараты, применяемые с этой целью, делятся на несколько групп: производные аминоглютетимида (мамомит 250 мг, ориметен 250 мг, средняя суточная доза — 750 мг/сут, максимальная суточная доза — 1000–1500 мг/сут), производные кетоконазола (низорал 200 мг/сут, суточная доза — 400–600 мг/сут, максимальная суточная доза — 1000 мг/сут) и производные пара-хлорфенила (хлодитан, лизодрен, митотан, начальная доза — 0,5 г/сут, лечебная доза — 3–5 г/сут). Принципы медикаментозной терапии следующие: после определения степени переносимости лекарственного средства лечение надо начинать с максимальных доз. На фоне приема препарата необходимо осуществлять контроль за содержанием кортизола в плазме крови и суточной моче не реже чем один раз в 10–14 дней. В зависимости от уровня снижения кортизола в каждом конкретном случае подбирается поддерживающая доза препарата. Передозировка препаратами, блокирующими биосинтез стероидов в надпочечниках, может приводить к развитию надпочечниковой недостаточности.
Из препаратов, ингибирующих действие АКТГ, преимущественно используются бромокриптин-парлодел (в дозе 2,5 –5 мг) или отечественный препарат абергин, (в дозе 4–8 мг).
Коррекцию электролитного обмена необходимо проводить как до начала лечения основного заболевания, так и в ранний послеоперационный период. Наиболее целесообразно применение препаратов калия (раствор хлористого калия или таблеток ацетата калия 5,0 г и более в день) в сочетании с спиронолактонами, в частности верошпироном. Рекомендуемая доза верошпирона до 200 мг/сут перорально.
Подходы к лечению артериальной гипертонии при гиперкортицизме такие же, как и при артериальной гипертонии без повышения функции надпочечников. Надо отметить, что у большинства пациентов с БИК не удается достичь оптимального АД без снижения уровня кортизола.
Патогенетический подход к терапии сахарного диабета при гиперкортицизме предполагает эффективное воздействие на основные звенья: инсулинорезистентность периферических тканей и неспособность инсулярного аппарата преодолеть эту резистентность. Обычно предпочтение отдается сульфаниламидным препаратам второго поколения, так как они обладают большей активностью и меньшей гепато- и нефротоксичностью.
Начинать лечение сульфонилмочевинными препаратами следует с минимальной дозы. При необходимости дозу увеличивают, ориентируясь на результаты измерений уровня глюкозы в крови. Если лечение не дает желаемых результатов, следует сменить препарат. Во время лечения любыми сахароснижающими средствами больной должен соблюдать диету. Если лечение максимальными дозами производными сульфонилмочевины (ПСМ) оказывается безрезультатным, можно использовать их комбинацию с бигуанидами. Теоретическое обоснование необходимости комбинированной терапии основывается на том, что препараты этих групп имеют различные точки приложения своего основного действия. Метформин — 400 мг (cиофор — 500 и 850 мг, глюкофаж — 500, 850 и 1000 мг) — единственный на сегодняшний день препарат бигуанидов, который снижает инсулинорезистентность. Инсулинотерапия показана при БИК в тех случаях, когда не удается нормализовать уровень глюкозы в крови с помощью пероральных сахароснижающих препаратов или планируется хирургическое вмешательство. Применяется инсулин короткого действия, препараты средней длительности и длительного действия и их комбинация. Операция должна планироваться на первую половину дня: перед операцией вводят инсулин короткого действия или средней продолжительности действия п/к. Во время операции проводят инфузию 5% глюкозы в/в с добавлением инсулина короткого действия из расчета 5 — 10 ЕД/л, скорость инфузии — 150 мл/ч. Инфузию 5% глюкозы с инсулином короткого действия продолжают и после операции, пока больной не начнет самостоятельно принимать пищу. Затем пациент переводится на пероральные сахароснижающие препараты и осуществляется контроль сахара крови.
Лечение стероидного остеопороза (СОП) даже после ликвидации гиперкортицизма длительное. Препараты для лечения СОП условно можно разделить на три группы: средства, влияющие на процессы костной резорбции, препараты, стимулирующие костное формирование, и препараты многопланового действия. К препаратам, снижающим резорбцию костной ткани, относится кальцитонин (миокальцик). Этот препарат используется в двух лекарственных формах: в ампулах и в виде назального спрея. Курсы длительностью два месяца следует проводить три раза в год. Бисфосфонаты (фосамакс, ксидифон) относятся к препаратам, которые снижают резорбцию костной ткани. При терапии бисфосфонатами рекомендуется дополнительный прием солей кальция (500–1000 мг в сутки). Одним из наиболее эффективных препаратов, стимулирующих костеобразование и увеличивающих массу кости, являются соли фтора. Лечение продолжают от шести месяцев до одного года.
Считается, что анаболические стероиды уменьшают костную резорбцию и индуцируют положительный кальциевый баланс благодаря увеличению абсорбции кальция из кишечника и реабсорбции кальция почками. Кроме того, по некоторым данным, они стимулируют активность остеобластов и увеличение мышечной массы. Они назначаются в основном парентерально, прерывистыми курсами по 25–50 мг один-два раза в месяц в течение двух месяцев три раза в год.
Препараты активного метаболита витамина Д (оксидевит, альфа Д3-Тева) широко применяются при БИК. При СОП они используются в дозе 0,5–1,0 мкг/дн как в качестве монотерапии, так и в комбинации с другими препаратами (Д3+кальцитонин, Д3+соли фтора, Д3+бисфосфанаты). При комплексном лечении БИК и СОП также возможно применение препарата остеопан, содержащего кальций, витамин Д3, магний и цинк, назначая по две таблетки три раза в день.
Симптоматическое лечение СОП включает в себя обезболивающую терапию: анальгетики, назначение нестероидных противовоспалительных средств, а также центральных миорелаксантов, так как на генез боли при СОП оказывает влияние и спазм параспинальных мышц. Соли кальция самостоятельного значения при лечении стероидного ОП не имеют, но являются обязательным компонентом комплексной терапии. В клинической практике предпочтение в настоящее время отдается быстрорастворимым солям кальция. Кальций форте содержит в одной растворимой таблетке 500 мг кальция-элемента. Препараты кальция следует назначать в один прием, на ночь. При лечении СОП кальций надо применять ежедневно в суточной дозе 500–1000 мг в комбинации с препаратами патогенетической терапии ОП. Абсолютным показанием для назначения корсета при СОП являются боли в спине и наличие компрессионных переломов тел позвонков.
Прогноз БИК зависит от длительности, тяжести заболевания и возраста больного. При небольшой длительности заболевания, легкой форме и возрасте до 30 лет прогноз благоприятный. После адекватного лечения наблюдается выздоровление. При среднетяжелой форме заболевания и при длительном его течении у больных после нормализации функции гипофиза и надпочечников часто остаются необратимые изменения со стороны сердечно-сосудистой системы и костной системы, которые требуют дополнительного лечения. Вследствие двусторонней адреналэктомии у пациентов развивается хроническая надпочечниковая недостаточность. При стабильной надпочечниковой недостаточности и отсутствии тенденции к росту аденомы гипофиза прогноз благоприятный, хотя трудоспособность больных ограничена.
С. Д. Арапова, кандидат медицинских наук
Е. И. Марова, доктор медицинских наук, профессор
Эндокринологический научный центр РАМН, Москва
Источник
