Клещ derm pteronyssinus есть аллергия
Научно-диагностический центр лабораторных технологий

Личный кабинет клиента
В корзине пусто!
Аллерген клеща домашней пыли Dermatophagoides farina D2
D2 Dermatophagoides farina — Клещ домашней пыли – один из важнейших аллергенов. Он живет в каждом доме круглогодично, но периодически численность его резко возрастает. Это наиболее распространенный бытовой аллерген, являющийся фактором риска аллергических заболеваний.Пылевые клещи вида Dermatophagoides farinae также, как и Dermatophagoides pteronyssinus, являются частой причиной бытовой аллергии, обитают в кроватях и постельных принадлежностях, были обнаружены также в муке. Питаются чешуйками эпидермиса. Живут в симбиозе с микроскопическими плесневыми грибами, обитающими в матрацах. Один грамм пыли из матраца может содержать до 15000 клещей. Аллергия на домашнюю пыль (на самом деле, на клещей, особенно на их экскременты) проявляется астмой, ринитом, отёком Квинке, атопическим дерматитом и конъюнктивитом. Попадают микроклещи в организм человека ингаляционным путём, но их можно обнаружить и на коже, а иногда в моче и мокроте.
Симптомы заболевания отмечаются круглогодично, но хуже осенью и зимой, когда влажность выше. Эти клещи могут давать перекрёстную реакцию с клещами Dermatophagoides pteronyssinus и амбарными клещами, иногда с паутинными клещами, обитающими во фруктовых садах, а также с представителями семейства ракообразных (пищевая аллергия на креветок и крабов).Определение специфического иммуноглобулина Е к данному аллергену в повышенном количестве указывает на наличие сенсибилизации организма к этому аллергену.
Подготовка к исследованию
Не принимать пищу в течение 2-3 часов перед сдачей анализа, можно пить чистую негазированную воду.
Показания к исследованию
Диагностика аллергических заболеваний (бронхиальная астма, поллинозы, атопический дерматит, экзема, пищевая аллергия, лекарственная аллергия, респираторные аллергозы) в следующих случаях: ранний детский возраст (кожные пробы можно делать только детям старше 5 лет);
высокая степень сенсибилизации пациента, когда возможно развитие анафилактического шока;
непрерывно рецидивирующее течение заболевания без периодов ремиссии;
невозможность отмены антиаллергических препаратов, которые могут повлиять на результаты проб на пациенте;
поливалентная сенсибилизация, когда нет возможности провести тестирование in vivo сразу со всеми предполагаемыми аллергенами в ограниченные сроки обследования;
низкая реактивность кожи, в частности, у лиц раннего детского возраста;
уртикарный дермографизм;
острая фаза заболевания и, в частности, поражения кожных покровов;
ложноположительный или ложноотрицательный результат при кожном тестировании.
Интерпретация
Концентрации специфического Ig E, кЕдА/л
Источник
Клещ derm pteronyssinus есть аллергия
Количественное определение в крови специфических антител класса иммуноглобулинов E, появляющихся при наличии аллергической реакции к клещу домашней пыли Dermatophagoides pteronyssinus.
Специфический иммуноглобулин класса Е к пироглифному клещу D. pteronyssinus; пироглифидные клещи.
Синонимы английские
ImmunoCAP d1 (House Dust Mite, Dermatophagoides pteronyssinus), IgE; Allergen d1: Dermatophagoides pteronyssinus (Mites), IgE — ImmunoCAP; Specific immunoglobulin E to the D.pteronyssinus, Spec. IgE to the dust mite D.pteronyssinus (serum).
Иммунофлюоресценция на твердой фазе (ImmunoCAP).
кЕдА/л (килоединица аллергена на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Аллерген – это вещество, вызывающее аллергическую реакцию. При атопических заболеваниях аллергены стимулируют образование антител класса IgE и являются причинными факторами развития клинических симптомов аллергических заболеваний. Выявление в крови специфических иммуноглобулинов Е к определенному аллергену подтверждает его роль в развитии аллергической реакции I типа (реагиновой), а значит, позволяет определить возможного «виновника» аллергии и назначить соответствующие лечебные и профилактические мероприятия.
Клещи домашней пыли являются одними из основных источников аллергенов в помещениях и составляют большую часть домашней пыли. Клиническими проявлениями аллергии на белки клещей домашней пыли являются симптомы круглогодичного аллергического ринита, конъюнктивита, бронхиальной астмы, атопического дерматита.
Данные членистоногие размером около 0,3 мм не видны невооруженным глазом. Клещи домашней пыли питаются перхотью человека, которая накапливается в матрасах, подушках, на полу, коврах, мягких игрушках и мягкой мебели. Их количество максимально при температуре выше 20º С и относительной влажности более 80 %. Для людей, сенсибилизированых к домашним клещам, оптимальная влажность в помещении должна составлять не более 50 %. Среди представителей домашних клещей наиболее значимыми для развития аллергических реакций являются Dermatophagoides farinae и Dermatophagoides pteronyssinus. D. pteronyssinus предпочитает более влажную среду, чем D. farinae. В тропических странах важным источником аллергенов является клещ Blomia tropicalis. Считается, что около 50 % пациентов с аллергией и около 80 % детей с бронхиальной астмой сенсибилизированы к пылевым клещам. При сенсибилизации к клещу D. pteronyssinus возможны перекрестные реакции с аллергенами D. farinae и других пироглифидных клещей, а также с белками некоторых ракообразных.
Целью данного исследования является определение специфических IgE к аллергенам клеща D. pteronyssinus методом ImmunoCAP. Аллергодиагностика технологией ImmunoCAP характеризуется высокой точностью и специфичностью, что достигается обнаружением в малом количестве крови пациента даже низких концентраций IgE-антител. Методика является революционной и основана на иммунофлюоресцентном методе, что позволяет увеличить чувствительность в несколько раз, по сравнению с другими диагностическими способами. ВОЗ и Всемирная организация аллергологов признают диагностику с использованием ImmunoCAP как «золотой стандарт», так как эта методика доказала свою точность и стабильность результатов в независимых исследованиях.
Для чего используется исследование?
- Для диагностики сенсибилизации к пылевому клещу D. pteronyssinus у пациентов с аллергическими заболеваниями (аллергическим ринитом и конъюнктивитом, бронхиальной астмой, атопическим дерматитом);
- для оценки риска развития аллергических реакций на пылевого клеща D. pteronyssinus;
- для решения вопроса о проведении аллерген-специфической иммунотерапии.
Когда назначается исследование?
- При наличии следующих, указывающих на аллергический характер, симптомов при контакте с пылью: покраснение и зуд глаз, слезотечение; ринорея, зуд и/или заложенность носа; покраснение и зуд кожи, сыпь; отек гортани, кашель и бронхоспазм;
- при поливалентной сенсибилизации;
- при сомнительных результатах кожного тестирования и провокационных проб;
- при решении вопроса о проведении АСИТ.
Источник
Клещ derm pteronyssinus есть аллергия
Клещи домашней пыли (HDM, Dermatophagoides sp.) являются одним из самых распространенных источников воздушных аллергенов во всем мире, сенсибилизация HDM затрагивает от 1 % до 2 % населения мира, что эквивалентно 65–130 миллионам человек [1]. С XVII в. известно, что вдыхание домашней пыли может вызвать астму и ринит. Однако только в 1964 г. группа, работающая с Рейндертом Воорхорстом и супружеской парой Фрица Т. Спиксма и Марис И. Спиксма-Боземан, продемонстрировала, что наличие HDM в образцах пыли вызвало симптомы астмы [2]. Экспериментальные доказательства указывают на то, что HDM-специфические Th2-клетки играют центральную роль в аллергическом воспалительном ответе, продуцируя IL-4, IL-5, IL-13: IL-4 важен для аллергической сенсибилизации и продукции IgE; IL-5 обеспечивает выживаемость эозинофилов; IL-13 обусловливает плейотропные эффекты в легких [3].
Цель обзора: предоставить основные данные по содержанию аллергенов в экстракте клещей домашней пыли (HDM, Dermatophagoides sp.), описать возможные микробные компоненты, участвующие в индуцированной HDM поляризации T-клеток по Th2 типу.
Классификация аллергенов HMD по группам [3]
MD-2-подобный липид-связывающий белок
Трипсин-подобная сериновая протеаза
Хемотрипсин-подобная сериновая протеаза
Коллагенолитическая сериновая протеаза
Клещи домашней пыли относятся к семейству Pyroglyphidae, подклассу Acari, классу Arachid, роду Anthropods. Наиболее распространенными видами являются Dermatophagoides pteronyssinus и Dermatophagoides farinae. Существуют три вида экскреторных выделений клещей: личиночные шкурки, секрет латеральных желез и экскременты (фекальные шарики) [4]. Кроме идентифицированных HDM-аллергенов фекалии клеща содержат белковые и небелковые соединения, которые могут участвовать в активации врожденного иммунитета.
HDM рассматривается не только как носитель аллергена, а также как важный транспортер микробных PAMPs (консервативных молекулярных структур (паттернов), ассоциированных со специфическим патогеном), способных вызывать реакции врожденного иммунитета. Домашняя пыль, естественная среда обитания клещей, содержит большое количество ЛПС (липополисахарид, эндотоксин) и/или бактерий, а также β-глюканов и/или грибов, которые могут быть связаны с аллергенами HDM [5, 6]. Хитин, полимер из звеньев β-(1-4)-поли-N-ацетил-D-глюкозамина, входящий в состав экзоскелета клещей и обнаруженный в их фекалиях, поляризует иммунные ответы по типу Th1, Th2 и Th17 [7]. Было показано, что введение хитина in vivo в мышей рекрутирует IL-4-позитивные врожденные иммунные клетки, включая эозинофилы и базофилы [8]. Остальные примеси экстракта, такие как флагеллин и β-глюканы, активируют TLR5 и TLR2 соответственно [9]. Найденная в экстрактах клещей бактериальная рибосомальная РНК свидетельствует о наличии эндосимбионтов [10].
Аллергены HDM были классифицированы в соответствии с системой номенклатуры Линнея, которая поддерживается Всемирной организацией здравоохранения (ВОЗ) и Подкомитетом по номенклатуре Международного союза иммунологических обществ (IUIS). HDM-аллергены называются Der (первые три буквы рода Dermatophagoides), p или f (первая буква вида pteronyssinus или farinae) и число, представляющее порядок, в котором они были очищены или классифицированы [11]. Аллергены D. pteronyssinus и D. farinae гомологичны, имеют аналогичные биологические активности, среди них выделяют четыре класса соединений: протеазы; белки, имеющие сродство к липидам; непротеолитические ферменты и неферментативные компоненты (таблица).
Приблизительно 80–90 % всех людей, страдающих аллергией на клещей, реагируют с частично выраженными аллергическими симптомами на аллергены основных групп – 1 и 2. Der p 23, впервые идентифицированный в 2013 г., также классифицируется как основной аллерген, поскольку он также имеет большое клиническое значение (уровень сенсибилизации около 70 %). Специфичные для Der p 23 уровни IgE у тестируемых пациентов были сопоставимы с уровнями IgE с Der p 1 и Der p 2. Der p 1 и Der p 2 быстро элюируются из фекальных гранул в водных растворах, тогда как Der р 23 элюируется медленно и в меньших количествах [12]. Возможно, что Der p 23 способен напрямую активировать врожденную иммунную систему [13].
Белки первой группы рассматриваются как папаин-подобные цистеиновые протеазы; 3, 6 и 9 группы представляют собой трипсин-подобные, хемотрипсин-подобные и коллагенолитические сериновые протеазы соответственно. Эти протеазы, скорее всего, участвуют в пищеварении клеща, поскольку они были обнаружены в клетках отделенных от стенки кишечника и в фекалиях [14]. Однако в отличие от белков первой группы они играют незначительную роль в связывании с IgE. Протеазы D. pteronissinus активируют эозинофилы и бронхиальные эпителиальные клетки, инициируют высвобождение воспалительных медиаторов тучных клеток [15].
Группы 5, 7 и 21 могут связывать липиды, гликопротеины и гликолипиды для взаимодействия с врожденной иммунной системой и влиять на доставку антигена [16]. Аллергены этих групп выявляются примерно у 30 % пациентов с аллергией на клещей домашней пыли и связаны с началом аллергической астмы [2]. Исследование структуры димеризованного Der p 5 показало наличие большого гидрофобного кармана, который может представлять собой сайт для связывания гидрофобных лигандов, позволяющий, подобно 2-й группе аллергенов HDM, транспортировать PAMPs липидной природы [17]. Der p 5 также стимулирует продукцию IL-6 и IL-8 в эпителиальных клетках дыхательных путей человека [18]. Аллергены группы 7 обладают сходной структурой с ЛПС-связывающим белком (LBP) [19, 20]. В отличие от белков группы 2 они не связывают ЛПС, но могут взаимодействовать с другими лигандами, обеспечивая активацию TLR 2-4 [21].
Согласно структурным гомологиям последовательностей аллергены групп 2, 13 и 14 могут быть отнесены к белкам, связывающим жирные кислоты и липиды [21]. Der p 2 демонстрирует структурную гомологию с корецептором TLR4 MD-2 (11 % идентичности, 29 % сходства), известным также как лимфоцитарный антиген 96 (LY96) [22, 23]. Однако наибольшее сходство последовательностей и трехмерных структур Der p 2 имеет с NPC2 (Niemann-Picktype C2 proteins, белки Нимана – Пика типа С2) – 23,5 % идентичности, 44 % сходства. При помощи анализов связывания липидов и масс-спектрометрии было выяснено, что Der p 2, а также его гомолог Der f 2, аналогично NPC2 связывают холестерин. Аллергены группы 13 связываются с жирными кислотами и другими липидами, такими как эйкозаноиды и ретиноиды. Аллергены HDM 14 группы гомологичны семейству липид-транспортирующих белков LLTP (large lipid transfer protein), включающему аполипофорные или вителлогенин-подобные белки, которые, как предполагается, обладают функциями накопления и транспорта энергии [23].
Другие аллергены HDM проявляют ферментативную активность: группы 4, 8 и 20 – представляют собой амилазы, глутатион-S-трансферазы и аргинин-киназы соответственно, тогда как группы 12, 15 и 18 демонстрируют гомологию с хитиназами [3].
Белки тропомиозина и парамиозина составляют группы 10 и 11 соответственно. Тропомиозин Der p 10 также является второстепенным аллергеном, однако из-за высокой гомологии последовательности с другими тропомиозинами он является важным перекрестным аллергеном к продуктам животного происхождения и иногда связан с тяжелыми реакциями [2]. Der p 11, парамиозин клеща, играет вторичную роль у пациентов с респираторной формой аллергии на HDM, являясь основным аллергеном у пациентов с атопическим дерматитом. Аналогично Der p 14 и Der p 18, тропомиозин и парамиозин клеща не встречаются в фекалиях, что указывает на сенсибилизацию к этим аллергенам при контакте тела клеща с кожей. Было обнаружено, что контакт с кожей может вызывать аллергическую сенсибилизацию и даже может усиливать последующую респираторную аллергию на тот же антиген [24]. Группы 16 и 17 были идентифицированы как гельсолин-подобные и EF- Ca2+ связывающие белки [3].
Исследования подтвердили важность Толл-подобных рецепторов (TLR) в развитии аллергии на клещей домашней пыли [25]. Совместная активация клеток экстрактом из HDM и эндотоксином может стимулировать TLR4-зависимое аллергическое воспаление дыхательных путей при очень низких уровнях ЛПС. Гомология Der p 2 и MD-2 обусловливает активацию TLR4-сигнального пути на клетках бронхиального эпителия через прямое взаимодействие с Der p 2 в отсутствии связывания ЛПС с MD-2 [16]. Модель сенсибилизации дыхательных путей Der p 2+ЛПС вызывала аллергическую астму у мышей дикого типа и MD-2-дефицитных, но не TLR4-дефицитных, что явно подтверждает, что Der p 2 может переносить ЛПС на TLR4. Аллергенность белков 2-й группы является следствием аутоадъювантных свойств, что было подтверждено связыванием Der f 2 и ЛПС (афинность Der p 2 к ЛПС ниже, чем Der f 2) [26]. Der p 2 индуцирует аллергическую астму прямым связыванием с TLR4 или связыванием с TLR4 после взаимодействия с ЛПС [27]. Th2-смещенный ответ на Der p 2 при подкожном введении не зависит от функционального TLR4 (который, возможно, имеет защитную функцию против кожных аллергенов) [28].
Из-за наличия гидрофобного кармана в структуре белков-аллергенов HDM 2-й группы кроме ЛПС с ними также могут связываться другие липидные соединения, которые потенциально могут активировать гетеродимеры TLR1/TLR2 и TLR2/TLR6, проявляющие сродство к бактериальным липопептидам/липопротеинам. Рекомбинантный Der p 2 способен стимулировать гладкомышечные клетки дыхательных путей TLR4-независимым способом, через TLR2 по MyD88-зависимому сигнальному пути. [29]. Это указывает на то, что гидрофобный карман Der p 2 может транспортировать липиды, отличные от ЛПС, являющиеся лигандами TLR2. Der p 2 также способствует активации В-клеток человека через индукцию TLR4/MD-2 и NF-κB-зависимый синтез IL-1β, CXCL10, IL-8 и TNF-α [30]. In vitro показано, что Der p 2 взаимодействует с TLR4 при участии положительно заряженных аминокислотных остатков, индуцирует секрецию IL-6, IL-8 и MCP-1 в нормальных и аллергических лимфоцитах. Секретируемые в ответ на Der p 2 цитокины подавляют спонтанный апоптоз нейтрофилов [31], передача сигнала осуществляется при участии TLR4, Lyn, PI3K, Akt, ERK и NF-κB [32, 33].
Экстракт клещей D. pteronyssinus (DpE) стимулирует продукцию IL-4 и IL-13 в чувствительных к клещам базофилах при астме [34]. Показано, что DpE повышает экспрессию мРНК и секрецию белков MCP-1, IL-6 и IL-8 без участия протеаз, входящих в состав экстракта; в регуляции экспрессии MCP-1, IL-6 и IL-8 участвуют тирозинкиназа Src-семейства PKC δ и ERK, тогда как p38 MAPK участвует в регуляции экспрессии MCP-1 и IL-6 [35]. Следует отметить, что состав коммерческих экстрактов аллергенов из клещей домашней пыли может в значительной степени изменяться в зависимости от способа их подготовки, что приводит к их отличиям по ряду характеристик: содержание эндотоксина; различные количества основных групп аллергенов (Der p 1, Der p 2); отсутствие некоторых групп [14, 36]. Параллельно с исследованиями на экстрактах осуществляется изучение биологической активности рекомбинантных белков клеща (преимущественно исследуются белки 1, 2, 3, 6, 9 группы) [37].
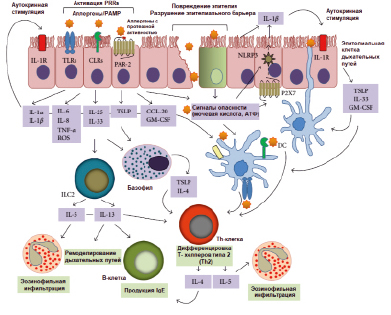
Упрощенная модель иммунной активации при аллергии HDM представлена на рисунке.
Упрощенная модель HDM-индуцированной иммунной активации, приводящей к аллергической астме [Jacquet A., 2013 (с изменениями)]
Джекет предложил заменить классификацию аллергенов согласно их способности стимулировать врожденные иммунные реакции. В таком контексте две группы аллергенов играют решающую роль в HDM-индуцированном врожденном иммунитете: протеазы (группы 1, 3, 6 и 9), которые непосредственно вызывают передачу сигналов через протеолитические атаки и липидсвязывающие белки (группы 2, 5, 7, 13, 14 и 21), которые могут переносить PAMPs на основе микробных липидов. Однако не выяснено, обладают ли липидсвязывающие белки собственной аллергенностью или их способность активировать клетки обусловлена связанными с ними липидами [3].
Клещей домашней пыли следует рассматривать как организм, несущий как собственные аллергены с характерными свойствами, так и содержащий эндосимбиотические и/или загрязняющие микробные компоненты. Собственные аллергены представлены двумя основными группами: белки пищеварительного тракта, выделяющиеся в окружающую среду в составе фекальных шариков, и структурные белки клеща. Фекальные шарики имеют диаметр 10–40 мкм и поэтому могут откладываться не только на слизистой оболочке верхних дыхательных путей, но и попадать в легкие. Следует отметить, что микробные соединения, обнаруженные в клещах домашней пыли, в значительной степени участвуют в индуцированной HDM Th2-поляризации посредством активации PRRs (рецепторов, распознающих молекулярные паттерны). В связи с этим необходимо уделять внимание идентификации микробных соединений, присутствующих в экстрактах или среде. Подробное изучение рецепторов и сигнальных путей, вовлеченных в аллергический ответ, позволит разработать более эффективное лечение для пациентов с аллергией на клещей домашней пыли.
Источник