Клещи домашней пыли дерматофагоидес
Клещи домашней пыли (HDM, Dermatophagoides sp.) являются одним из самых распространенных источников воздушных аллергенов во всем мире, сенсибилизация HDM затрагивает от 1 % до 2 % населения мира, что эквивалентно 65–130 миллионам человек [1]. С XVII в. известно, что вдыхание домашней пыли может вызвать астму и ринит. Однако только в 1964 г. группа, работающая с Рейндертом Воорхорстом и супружеской парой Фрица Т. Спиксма и Марис И. Спиксма-Боземан, продемонстрировала, что наличие HDM в образцах пыли вызвало симптомы астмы [2]. Экспериментальные доказательства указывают на то, что HDM-специфические Th2-клетки играют центральную роль в аллергическом воспалительном ответе, продуцируя IL-4, IL-5, IL-13: IL-4 важен для аллергической сенсибилизации и продукции IgE; IL-5 обеспечивает выживаемость эозинофилов; IL-13 обусловливает плейотропные эффекты в легких [3].
Цель обзора: предоставить основные данные по содержанию аллергенов в экстракте клещей домашней пыли (HDM, Dermatophagoides sp.), описать возможные микробные компоненты, участвующие в индуцированной HDM поляризации T-клеток по Th2 типу.
Классификация аллергенов HMD по группам [3]
MD-2-подобный липид-связывающий белок
Трипсин-подобная сериновая протеаза
Хемотрипсин-подобная сериновая протеаза
Коллагенолитическая сериновая протеаза
Клещи домашней пыли относятся к семейству Pyroglyphidae, подклассу Acari, классу Arachid, роду Anthropods. Наиболее распространенными видами являются Dermatophagoides pteronyssinus и Dermatophagoides farinae. Существуют три вида экскреторных выделений клещей: личиночные шкурки, секрет латеральных желез и экскременты (фекальные шарики) [4]. Кроме идентифицированных HDM-аллергенов фекалии клеща содержат белковые и небелковые соединения, которые могут участвовать в активации врожденного иммунитета.
HDM рассматривается не только как носитель аллергена, а также как важный транспортер микробных PAMPs (консервативных молекулярных структур (паттернов), ассоциированных со специфическим патогеном), способных вызывать реакции врожденного иммунитета. Домашняя пыль, естественная среда обитания клещей, содержит большое количество ЛПС (липополисахарид, эндотоксин) и/или бактерий, а также β-глюканов и/или грибов, которые могут быть связаны с аллергенами HDM [5, 6]. Хитин, полимер из звеньев β-(1-4)-поли-N-ацетил-D-глюкозамина, входящий в состав экзоскелета клещей и обнаруженный в их фекалиях, поляризует иммунные ответы по типу Th1, Th2 и Th17 [7]. Было показано, что введение хитина in vivo в мышей рекрутирует IL-4-позитивные врожденные иммунные клетки, включая эозинофилы и базофилы [8]. Остальные примеси экстракта, такие как флагеллин и β-глюканы, активируют TLR5 и TLR2 соответственно [9]. Найденная в экстрактах клещей бактериальная рибосомальная РНК свидетельствует о наличии эндосимбионтов [10].
Аллергены HDM были классифицированы в соответствии с системой номенклатуры Линнея, которая поддерживается Всемирной организацией здравоохранения (ВОЗ) и Подкомитетом по номенклатуре Международного союза иммунологических обществ (IUIS). HDM-аллергены называются Der (первые три буквы рода Dermatophagoides), p или f (первая буква вида pteronyssinus или farinae) и число, представляющее порядок, в котором они были очищены или классифицированы [11]. Аллергены D. pteronyssinus и D. farinae гомологичны, имеют аналогичные биологические активности, среди них выделяют четыре класса соединений: протеазы; белки, имеющие сродство к липидам; непротеолитические ферменты и неферментативные компоненты (таблица).
Приблизительно 80–90 % всех людей, страдающих аллергией на клещей, реагируют с частично выраженными аллергическими симптомами на аллергены основных групп – 1 и 2. Der p 23, впервые идентифицированный в 2013 г., также классифицируется как основной аллерген, поскольку он также имеет большое клиническое значение (уровень сенсибилизации около 70 %). Специфичные для Der p 23 уровни IgE у тестируемых пациентов были сопоставимы с уровнями IgE с Der p 1 и Der p 2. Der p 1 и Der p 2 быстро элюируются из фекальных гранул в водных растворах, тогда как Der р 23 элюируется медленно и в меньших количествах [12]. Возможно, что Der p 23 способен напрямую активировать врожденную иммунную систему [13].
Белки первой группы рассматриваются как папаин-подобные цистеиновые протеазы; 3, 6 и 9 группы представляют собой трипсин-подобные, хемотрипсин-подобные и коллагенолитические сериновые протеазы соответственно. Эти протеазы, скорее всего, участвуют в пищеварении клеща, поскольку они были обнаружены в клетках отделенных от стенки кишечника и в фекалиях [14]. Однако в отличие от белков первой группы они играют незначительную роль в связывании с IgE. Протеазы D. pteronissinus активируют эозинофилы и бронхиальные эпителиальные клетки, инициируют высвобождение воспалительных медиаторов тучных клеток [15].
Группы 5, 7 и 21 могут связывать липиды, гликопротеины и гликолипиды для взаимодействия с врожденной иммунной системой и влиять на доставку антигена [16]. Аллергены этих групп выявляются примерно у 30 % пациентов с аллергией на клещей домашней пыли и связаны с началом аллергической астмы [2]. Исследование структуры димеризованного Der p 5 показало наличие большого гидрофобного кармана, который может представлять собой сайт для связывания гидрофобных лигандов, позволяющий, подобно 2-й группе аллергенов HDM, транспортировать PAMPs липидной природы [17]. Der p 5 также стимулирует продукцию IL-6 и IL-8 в эпителиальных клетках дыхательных путей человека [18]. Аллергены группы 7 обладают сходной структурой с ЛПС-связывающим белком (LBP) [19, 20]. В отличие от белков группы 2 они не связывают ЛПС, но могут взаимодействовать с другими лигандами, обеспечивая активацию TLR 2-4 [21].
Согласно структурным гомологиям последовательностей аллергены групп 2, 13 и 14 могут быть отнесены к белкам, связывающим жирные кислоты и липиды [21]. Der p 2 демонстрирует структурную гомологию с корецептором TLR4 MD-2 (11 % идентичности, 29 % сходства), известным также как лимфоцитарный антиген 96 (LY96) [22, 23]. Однако наибольшее сходство последовательностей и трехмерных структур Der p 2 имеет с NPC2 (Niemann-Picktype C2 proteins, белки Нимана – Пика типа С2) – 23,5 % идентичности, 44 % сходства. При помощи анализов связывания липидов и масс-спектрометрии было выяснено, что Der p 2, а также его гомолог Der f 2, аналогично NPC2 связывают холестерин. Аллергены группы 13 связываются с жирными кислотами и другими липидами, такими как эйкозаноиды и ретиноиды. Аллергены HDM 14 группы гомологичны семейству липид-транспортирующих белков LLTP (large lipid transfer protein), включающему аполипофорные или вителлогенин-подобные белки, которые, как предполагается, обладают функциями накопления и транспорта энергии [23].
Другие аллергены HDM проявляют ферментативную активность: группы 4, 8 и 20 – представляют собой амилазы, глутатион-S-трансферазы и аргинин-киназы соответственно, тогда как группы 12, 15 и 18 демонстрируют гомологию с хитиназами [3].
Белки тропомиозина и парамиозина составляют группы 10 и 11 соответственно. Тропомиозин Der p 10 также является второстепенным аллергеном, однако из-за высокой гомологии последовательности с другими тропомиозинами он является важным перекрестным аллергеном к продуктам животного происхождения и иногда связан с тяжелыми реакциями [2]. Der p 11, парамиозин клеща, играет вторичную роль у пациентов с респираторной формой аллергии на HDM, являясь основным аллергеном у пациентов с атопическим дерматитом. Аналогично Der p 14 и Der p 18, тропомиозин и парамиозин клеща не встречаются в фекалиях, что указывает на сенсибилизацию к этим аллергенам при контакте тела клеща с кожей. Было обнаружено, что контакт с кожей может вызывать аллергическую сенсибилизацию и даже может усиливать последующую респираторную аллергию на тот же антиген [24]. Группы 16 и 17 были идентифицированы как гельсолин-подобные и EF- Ca2+ связывающие белки [3].
Исследования подтвердили важность Толл-подобных рецепторов (TLR) в развитии аллергии на клещей домашней пыли [25]. Совместная активация клеток экстрактом из HDM и эндотоксином может стимулировать TLR4-зависимое аллергическое воспаление дыхательных путей при очень низких уровнях ЛПС. Гомология Der p 2 и MD-2 обусловливает активацию TLR4-сигнального пути на клетках бронхиального эпителия через прямое взаимодействие с Der p 2 в отсутствии связывания ЛПС с MD-2 [16]. Модель сенсибилизации дыхательных путей Der p 2+ЛПС вызывала аллергическую астму у мышей дикого типа и MD-2-дефицитных, но не TLR4-дефицитных, что явно подтверждает, что Der p 2 может переносить ЛПС на TLR4. Аллергенность белков 2-й группы является следствием аутоадъювантных свойств, что было подтверждено связыванием Der f 2 и ЛПС (афинность Der p 2 к ЛПС ниже, чем Der f 2) [26]. Der p 2 индуцирует аллергическую астму прямым связыванием с TLR4 или связыванием с TLR4 после взаимодействия с ЛПС [27]. Th2-смещенный ответ на Der p 2 при подкожном введении не зависит от функционального TLR4 (который, возможно, имеет защитную функцию против кожных аллергенов) [28].
Из-за наличия гидрофобного кармана в структуре белков-аллергенов HDM 2-й группы кроме ЛПС с ними также могут связываться другие липидные соединения, которые потенциально могут активировать гетеродимеры TLR1/TLR2 и TLR2/TLR6, проявляющие сродство к бактериальным липопептидам/липопротеинам. Рекомбинантный Der p 2 способен стимулировать гладкомышечные клетки дыхательных путей TLR4-независимым способом, через TLR2 по MyD88-зависимому сигнальному пути. [29]. Это указывает на то, что гидрофобный карман Der p 2 может транспортировать липиды, отличные от ЛПС, являющиеся лигандами TLR2. Der p 2 также способствует активации В-клеток человека через индукцию TLR4/MD-2 и NF-κB-зависимый синтез IL-1β, CXCL10, IL-8 и TNF-α [30]. In vitro показано, что Der p 2 взаимодействует с TLR4 при участии положительно заряженных аминокислотных остатков, индуцирует секрецию IL-6, IL-8 и MCP-1 в нормальных и аллергических лимфоцитах. Секретируемые в ответ на Der p 2 цитокины подавляют спонтанный апоптоз нейтрофилов [31], передача сигнала осуществляется при участии TLR4, Lyn, PI3K, Akt, ERK и NF-κB [32, 33].
Экстракт клещей D. pteronyssinus (DpE) стимулирует продукцию IL-4 и IL-13 в чувствительных к клещам базофилах при астме [34]. Показано, что DpE повышает экспрессию мРНК и секрецию белков MCP-1, IL-6 и IL-8 без участия протеаз, входящих в состав экстракта; в регуляции экспрессии MCP-1, IL-6 и IL-8 участвуют тирозинкиназа Src-семейства PKC δ и ERK, тогда как p38 MAPK участвует в регуляции экспрессии MCP-1 и IL-6 [35]. Следует отметить, что состав коммерческих экстрактов аллергенов из клещей домашней пыли может в значительной степени изменяться в зависимости от способа их подготовки, что приводит к их отличиям по ряду характеристик: содержание эндотоксина; различные количества основных групп аллергенов (Der p 1, Der p 2); отсутствие некоторых групп [14, 36]. Параллельно с исследованиями на экстрактах осуществляется изучение биологической активности рекомбинантных белков клеща (преимущественно исследуются белки 1, 2, 3, 6, 9 группы) [37].
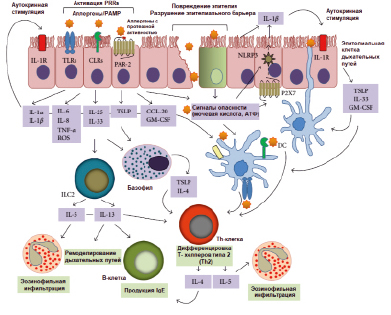
Упрощенная модель иммунной активации при аллергии HDM представлена на рисунке.
Упрощенная модель HDM-индуцированной иммунной активации, приводящей к аллергической астме [Jacquet A., 2013 (с изменениями)]
Джекет предложил заменить классификацию аллергенов согласно их способности стимулировать врожденные иммунные реакции. В таком контексте две группы аллергенов играют решающую роль в HDM-индуцированном врожденном иммунитете: протеазы (группы 1, 3, 6 и 9), которые непосредственно вызывают передачу сигналов через протеолитические атаки и липидсвязывающие белки (группы 2, 5, 7, 13, 14 и 21), которые могут переносить PAMPs на основе микробных липидов. Однако не выяснено, обладают ли липидсвязывающие белки собственной аллергенностью или их способность активировать клетки обусловлена связанными с ними липидами [3].
Клещей домашней пыли следует рассматривать как организм, несущий как собственные аллергены с характерными свойствами, так и содержащий эндосимбиотические и/или загрязняющие микробные компоненты. Собственные аллергены представлены двумя основными группами: белки пищеварительного тракта, выделяющиеся в окружающую среду в составе фекальных шариков, и структурные белки клеща. Фекальные шарики имеют диаметр 10–40 мкм и поэтому могут откладываться не только на слизистой оболочке верхних дыхательных путей, но и попадать в легкие. Следует отметить, что микробные соединения, обнаруженные в клещах домашней пыли, в значительной степени участвуют в индуцированной HDM Th2-поляризации посредством активации PRRs (рецепторов, распознающих молекулярные паттерны). В связи с этим необходимо уделять внимание идентификации микробных соединений, присутствующих в экстрактах или среде. Подробное изучение рецепторов и сигнальных путей, вовлеченных в аллергический ответ, позволит разработать более эффективное лечение для пациентов с аллергией на клещей домашней пыли.
Источник
Клещи пыли
Клещи пыли. Виды: Dermatophagoides pteronyssinus, D. farinae, D. evansi, Euroglyphus maynei, E. longior, Hirstia chelidonis.
Клещи пыли семейства пироглифоидных (Pyroglyphydae). В пыли, собранной в жилых помещениях с ковров, дорожек, полов и т. д., обнаружено более 130 видов клещей размером 0,2-0,6 мм. Одни виды клещей домашней пыли питаются грибным мицелием (фитофаги), другие виды питаются продуктами животного происхождения (кератофаги). И те и другие находят для себя прекрасные условия для жизни в подушках и матрасах, в которых имеет место разложение органики и развитие грибковой флоры, находятся пух, перо, частички слущивающейся кожи человека, а также образуются оптимальные температура и влажность.
Из них наиболее распространенный «постельный» клещ (Dermatophagoides pteronyssinus) . Эти клещи обитают в продуктах шелушения эпидермиса, которые скапливаются в постели, в постельном белье, в пыли подушек, матрасов, одеял. Вне постели клещей можно обнаружить в обивке диванов, стульев и др. Продукты жизнедеятельности, фрагменты мертвых клещей и личиночных шкурок, попадая с пылью в дыхательные пути и пищеварительный тракт, иногда и через кожные покровы, вызывают аллергические заболевания (бронхиальная астма, бронхиты, ринит, конъюктивит, нейродермит и т. д.).
Клещи домашней пыли развиваются по схеме: яйцо – личинка – протонимфа – тритонимфа – имаго. При благоприятных условиях (температура 28-30⁰С, относительная влажность воздуха более 70%, влажность субстрата – 10-14%) цикл развития клещей занимает около 1-1.5 месяца. Самки живут до 2-3,5 месяцев. В течение жизни самка может отложить до 300 яиц.
Ежедневное пребывание человека в постели в течение 6-8 часов во время сна приводит к повышению температуры в матрасе приблизительно на 8 градусов по сравнению с комнатной, а относительной влажности – на 7.5%.
Таким образом, микроклимат постели в течение более чем трети суток оказывается близким к оптимальному для развития клещей домашней пыли.
Вредоносность: Аллергенными являются как сами клещи, так и их экскременты и личиночные шкурки. В вечернее время, при расстилании постели и взбивании подушек для сна, в воздух поднимается большое количество пыли с клещами и продуктами их жизнедеятельности, при вдыхании которых у больных бронхиальной астмой часто провоцируется приступ.
При численности клещей более 100 экземпляров в 1 грамме пыли возникает риск развития аллергических заболеваний, клещи вызывают «пылевую» (атопическую) бронхиальную астму, риниты и атопические дерматиты. При численности клещей более 500 экземпляров в 1 грамме пыли может возникнуть астматический приступ. В постельных принадлежностях численность клещей может достигать 3000 экземпляров и более.
Методы борьбы и защиты:
Рекомендуется регулярная сухая уборка помещений и постельных принадлежностей мощным пылесосом со специальными фильтрами, сорбирующими или удерживающими аллергены.
Имеются данные, что обработка матраса пылесосом в течение 5 минут приводит к удалению 90% клещей, находящихся на его поверхности и в наружном слое набивки.
Поэтому регулярные обработки пылесосом постельных принадлежностей, мягкой мебели и, особенно, ковров (которые вообще не рекомендуется иметь в квартирах больных-аллергиков), а также частая смена постельного и нательного ночного белья приводят к значительному снижению численности клещей домашней пыли.
Для аллергиков можно рекомендовать замену пуховых, перьевых и ватных постельных принадлежностей на изделия из материалов, препятствующих развитию клещей, например, полиуретановые матрасы, синтепоновые наполнители подушек и так далее.
Основным фактором, определяющим возможность существования и нормальной жизнедеятельности клещей домашней пыли является высокая влажность воздуха.
Поэтому, борьба с высокой влажностью в доме – основа для снижения численности клещей домашней пыли.
Для снижения и поддержания низкой влажности воздуха в квартире необходимо как можно чаще проветривать помещения, не пользоваться увлажнителями воздуха, сократить количество комнатных растений, имеющиеся аквариумы закрывать плотными крышками.
Другими способами уничтожения клещей домашней пыли являются:
— стирка постельного белья в стиральной машине при температуре воды не ниже 60⁰С;
— проглаживание одеял, простыней и наволочек горячим утюгом;
— промывание пера подушек и перин горячей водой;
— просушивание подушек и других пухо-перьевых изделий на солнце не менее 2-х часов;
— промораживание подушек и других пухо-перьевых изделий при температуре 18-20⁰С.
Облучение ультрафиолетовыми лучами в течение 2-х часов вызывает не только гибель клещей, но и приводит к потере их аллергенной активности. Поэтому, для борьбы с клещами особенно рекомендуется просушка на солнце постельных принадлежностей. Аналогичный эффект отмечается при стирке постельного белья в стиральной машине горячей водой.
Применение химических средств борьбы с клещами домашней пыли должно сочетаться с механическим удалением (использование пылесоса) погибших клещей, так как даже мёртвые особи, а тем более оставшиеся продукты их жизнедеятельности продолжают оставаться аллергенными.
Кроме того, нежелательно часто применять инсектициды в жилищах, в которых проживают аллергики, у которых со временем увеличивается спектр агентов, оказывающих аллергизирующее действие.
Известными акарицидными веществами являются пиретроиды.
Широко используются для санации жилых помещений лиц с клещевой аллергией препараты на основе бензилбензоата, которые не вызывают каких-либо симптомов гиперреактивности бронхов аллергиков.
Дезинсекционной обработке подвергают матрасы, ковры и коврики, шторы, предметы мягкой мебели, особенно в спальных комнатах. Перед нанесением акарицидов все места, подлежащие обработке, должны быть вычищены пылесосом. Через 2-3 часа после обработки, когда препарат на обработанных поверхностях высохнет, чистку пылесосом следует повторить.
Статьи на эту тему:
1. Адо А.Д. Общая аллергология. М., Медицина, 1978. 464 с.
2. Дубинин В.Б., Гусельникова М.И., Разнатовский И.М. Нахождение кожеедных клещей Шереметьевского (Dermatophagoides sheremetewskyi Bogdanov, 1864) при некоторых заболеваниях кожи человека // Бюл. МОИП. Отд. биол. 1956. Т. 61, № 3. С. 43-50.
3. Дубинина Е.В. Эколого-фаунистические исследования клещей пыли в связи с проблемой аллергии // Паразитол. сб Т. 33. Л., Наука, 1985. С. 209-229.
4. Дубинина Е.В., Плетнев Б.Д. Методы обнаружения и определения аллергенных клещей домашней пыли. Л., 1977. 51 с.
5. Павловский Е.Н. Руководство по паразитологии человека с учением о переносчиках трансмиссивных болезней. Т. 2. Изд. 5, М.; Л., 1948. С. 527-1022.
6. Плетнев Б.Д., Дмитриева Н.П. Акарофауна домашней пыли у больных атопическим дерматитом // Вест. дерматологии и венерологии. 1977. № 2. С. 32-36.
Источник