Клетки печени крысы под микроскопом
Зависимость большинства процессов жизнедеятельности организма от температуры окружающей среды делает температурные воздействия важнейшим фактором экологии, который может иметь решающее значение для выживания человека. С воздействием низких и сверхнизких температур человеку часто приходится встречаться при работе на различных производствах, а также в силу проживания – в некоторых климатических зонах. При этом пребывание организма в условиях гипотермического воздействия может приводить к значительным метаболическим и функциональным изменениям.
В условиях гипотермии печень как орган, вносящий значительный вклад в термопродукцию, играет очень важную роль [1–3]. За счет сложных биохимических реакций этот орган способен обеспечивать приспособляемость организма к сложным условиям существования. Печень обеспечивает пластические и энергетические процессы, а также регулирует адаптивные компенсаторно-приспособительные процессы, происходящие при воздействии всех экзогенных и эндогенных неблагоприятных процессов, и эта регуляция осуществляется даже тогда, когда повреждающие факторы не обладают выраженным гепатотропным эффектом [4]. Поэтому морфофункциональное состояние печени является отражением не только функционального состояния самого органа, но и реакции организма в целом.
Морфологические изменения органов человека и животных при воздействии неблагоприятных экзогенных факторов широко изучаются в последние годы [5–7]. Однако гистоструктура печени при воздействии гипотермии исследована лишь в ряде работ [8, 9], полученные данные противоречивы. Это касается, в частности, особенностей реакций гепатоцитов на холодовой фактор, характеристики числа двуядерных гепатоцитов и реакции ядер клеток печени в целом [10, 11].
Таким образом, сведения о влиянии гипотермии на гистоструктуру печени немногочисленны, а вопросы морфологии клеточного ядра гепатоцитов освещены недостаточно, поэтому необходимо проведение более детального изучения динамики морфологических изменений, происходящих в ядрах гепатоцитов при действии холодового фактора.
Цель исследования: проанализировать динамику патоморфологических изменений состояния ядер клеток печени крыс породы Вистар после воздействия однократной глубокой иммерсионной гипотермии.
Материалы и методы исследования
Исследование было проведено на 15 самцах крыс линии Вистар массой 200–250 граммов. Животных (n = 10) подвергали однократной глубокой водной (иммерсионной) гипотермии, которую моделировали помещением экспериментальных животных в индивидуальных клетках в воду температурой 5°С при температуре окружающей среды 7°С. Когда животные достигали глубокой степени гипотермии, воздействие холодового фактора прекращали. Критерием достижения глубокой степени гипотермии являлась ректальная температура 20–25°С. Время воздействия холодового фактора в среднем составляло 40±5 мин. Непосредственно сразу после прекращения охлаждения животные выводились из эксперимента декапитацией. Контрольную группу составляли 5 крыс, которых в индивидуальных клетках помещали в воду температурой 30°С при температуре окружающей среды 22–25°С.
Для гистологического исследования кусочки ткани печени фиксировали в течение 24 часов в 10%-ном растворе нейтрального формалина, после проводили обработку препаратов в автомате TISSUE-TEK VIPTM6 (Sakkura, Nagano Japan) с последующей заливкой в парафин в станции парафиновой заливки TISSUE-TEK TEC 5 (Sakkura, Nagano, Japan). На роторном микротоме Accu-Cut SRM (Sakkura, Китай) изготавливали срезы толщиной 5–7 мкм. В автостейнере TISSUE-TEK Prisma (Sakkura, Nagano, Japan) препараты окрашивали гематоксилин-эозином.
Для определения плоидности ядер гепатоцитов препараты окрашивали методом Фельгена с использованием холодного гидролиза в 1н. HCl в течение 1 часа 30 минут. Среднее содержание ДНК в ядре малого лимфоцита принимали за диплоидное значение (2с). Плодометрические измерения осуществляли в сертифицированной морфометрической программе ВидиоТест-Морфология 5.2. («ВидиоТест», Санкт-Петербург) с помощью специализированных модулей «Стандарт» и «Плоидность». Строили гистограммы распределения гепатоцитов по индексу накопления ДНК (ИНДНК) в ядре.
Для выявления гетерохроматина гистологические срезы окрашивали в 2%-ном растворе орсеина на 45%-ном растворе уксусной кислоты в течение 30 минут. Затем препараты фотографировали при помощи микроскопа Leica DM 750 E200 (Германия) с цифровой видеокамерой Leica EC3 (Германия) при увеличении х1000. Определяли среднее количество гранул гетерохроматина на 1 ядро, их локализацию и высчитывали содержание доли гетерохроматина от общей площади ядра клетки. Исследовали не менее 25–30 ядер клеток.
Окрашивание ядрышковых организаторов (AgNOR) проводили по двухступенчатому методу Daskal Y. et al. в нашей модификации [12]. Под масляной иммерсией микроскопа при увеличении х1000 высчитывали число ядрышек, площадь одного ядрышкового организатора и ядерно-ядрышковое соотношение в относительных единицах (отн. ед.).
Статистическую обработку полученных данных проводили с помощью пакета статистических программ Statistica 10.0. и пакета статистического анализа программы MS EXСEL 2010. Для каждой из полученных величин высчитывали среднее (M) и ошибку среднего (m). Гипотеза о нормальности распределения вероятности данных проверялась с помощью критерия Шапиро–Уилка. Достоверность данных оценивалась с помощью параметрического критерия t-теста Стьюдента. Критическое значение уровня статистической значимости было равно 0,05.
Результаты исследования и их обсуждение
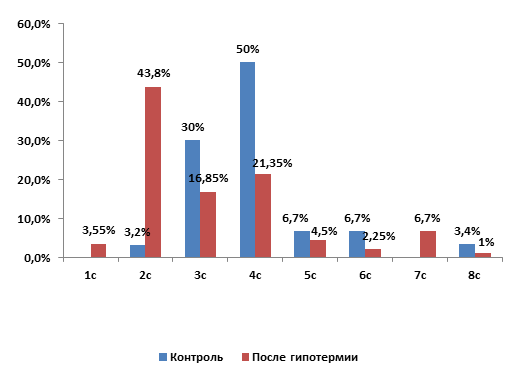
Контрольная группа. Морфологический анализ структуры ядер клеток печени животных контрольной группы позволил выявить следующее. Большинство гепатоцитов было одноядерными (79±1,5%), процент содержания двуядерных клеток составил 21±1,5%. При плоидометрическом исследовании ядер ИНДНК в среднем составил 3,9с±0,2. Ядра были представлены шестью уровнями плоидности: клонов клеток с ИНДНК 2с было 3,2%, 3с – 30%; 4c – 50%; 5c – 6,7%; 6c – 6,7% и 8с – 3,4% (табл.) (рис. 1).
Рис. 1. Гистограмма, характеризующая ИНДНК в группе контроля и при гипотермии.
По оси абсцисс – ИНДНК; по оси ординат – процентное содержание клеток
Морфометрические и морфофункциональные параметры ядер гепатоцитов при гипотермии в сравнении с группой контроля (М±m)
Источник
Клетки печени крысы под микроскопом
Повышенная продукция глюкозы печенью в результате угнетения гликолиза и усиления глюконеогенеза является характерной чертой сахарного диабета (СД) 2 типа. Данные процессы – ответственные за гипергликемию у больных СД 2 типа натощак. В то же время рост концентрации глюкозы в крови после приема пищи (постпрандиальной гликемии) связан с торможением утилизации глюкозы периферическими тканями, в первую очередь мышцами [1]. Это обусловлено нарушением синтеза гликогена в результате снижения активности гликогенсинтетазы и ослабления процессов окисления глюкозы вследствие дефекта в пируватдегидрогеназном комплексе. Свой вклад в данный процесс вносят изменения в секреторной функции панкреатических бета-клеток, что проявляется в торможении первой фазы инсулинового ответа и развитии гипергликемии [5; 8].С целью изучения сравнительной характеристики ультраструктуры печени в норме и при сахарном диабете в эксперименте проведено настоящее исследование.
Материал и методы исследования
Материалом исследования явились половозрелые крысы-самцы линии «Вистар» массой 100-130 г в количестве 90 штук. Перед забором материала подопытных животных усыпляли с помощью внутрибрюшинного наркоза с использованием тиопентала натрия. Забирали небольшую часть ткани печени крыс, которую помещали сразу в большую каплю 2%-ного раствора четырехокиси осмия на 0,1 М фосфатном буфере с сахарозой. Далее вырезали полоски ткани печени размером 0,8 х 0,1 х 0,1 см и переносили их в другую каплю фиксирующего раствора, размещенного на кусочке зубоврачебного воска ледяной плиты. Из полосок вырезали блоки ткани печени кубической формы размером 1 мм3, которые фиксировали 2%-ным раствором четырехокиси осмия на 0,1 М фосфатном буфере (рН 7,36) с добавлением сахарозы в течение двух часов на ледяной бане, после чего их отмывали буферным раствором [1]. Водонерастворимые смолами и отмытые от остатков фиксаторов тканевые блоки проводили через спирты восходящей концентрации и абсолютный ацетон. Затем материал помещали в смесь эпоксидных смол эпон-аралдит путем проведения через растворы возрастающей концентрации, после чего их помещали в эпон-аралдит, находившийся в глицериновых капсулах [2; 3]. Полимеризацию материала проводили поэтапно при разных температурах от 36 до 60 °С в течение 24 часов. Ультратонкие срезы готовили на ультрамикротоме УМТП — 3М с помощью стеклянных ножей, изготовленных на приборе ССН — 1. Для исследования отбирали срезы серебристого или нежно-лимонного цвета. Срезы контрастировали сначала в 2℅-ном растворе уранилацетата [7], а затем – цитрата свинца [6]. Изучение и фотографирование материала проводили с помощью микроскопа УЕМВ — 100К .
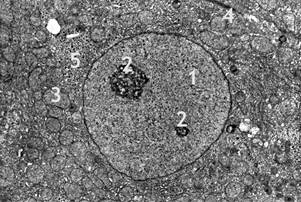
В норме у интактных крыс печеночные пластинки построены из гепатоцитов, объединенных с помощью плотных контактов, образующих желчные канальцы. При ультраструктурном исследовании в цитоплазме гепатоцитов хорошо выражены канальцы эндоплазматической сети, многочисленные лизосомы и пероксисомы, цистерны комплекса Гольджи, расположенные в различных отделах клеток. Митохондрии имеют сферическую или овальную форму от 0,8 до 2 мкм в диаметре, небольшую численность крист и электронноплотный матрикс с митохондриальными гранулами. В цитоплазме гепатоцитов находятся включения гликогена и липидов. Гранулы гликогена местами образуют агрегаты в виде розеток, тогда как липидные гранулы имеют вариабельнную электронную плотность и не окружены мембранами. Ядра, как правило, расположены в центре гепатоцитов и имеют овальную или сферическую форму с просветленным хроматином. Ядра содержат 1-2 ядрышка и имеют широкопетлистую ретикулярную структуру (рис. 1).
Рис. 1. Печень интактной крысы. Фрагмент гепатоцита. Увеличение x 5000.
1 – ядро; 2 – ядрышки; 3 – митохондрии; 4 – канальцы эндоплазматической сети; 5 – включения гликогена.
Эндотелиоциты отделяют пространства синусоидов от пиресинусоидальних пространств и имеют продолговатую форму, а их ядра располагаются в центре. Вокруг полюсов ядра находится компактная зона органелл с цистернами комплекса Гольджи, канальцами агранулярной и гранулярной эндоплазматической сети и многочисленными митохондриями. Наибольшей протяженностью характеризуется периферийная зона, в которой расположены немногочисленные органеллы. Она содержит плазмолемные везикулы, связанные с базальной и адлюменальной поверхностями плазмолемы. В периферийной части эндотелиоцитов расположены фенестры, не затянутые диафрагмами. В месте контактов эндотелиоциты содержат многочисленные отростки, благодаря которым образуются ситообразные зоны в стенке синусоидов. Базальная мембрана вокруг эндотелиальных клеток не образует сплошного слоя, ее фрагменты выявляются вокруг периферической зоны эндотелиоцитов. В просветах синусоидов и между эндотелиоцитами расположены звездчатые макрофагоциты. Они имеют многочисленные псевдоподии и складки мембраны с ядрами бобовидной формы. Вблизи вогнутой поверхности ядра находятся цистерны комплекса Гольджи и многочисленные лизосомы. В просветах синусоидов обнаруживаются печеночные клетки-убийцы. Они имеют сферическую форму, электронноплотные ядра и своими отростками фиксируются к плазмолемме эндотелиоцитов. Их цитоплазма содержит гранулы с электронноплотным центром, а также фагоцитарные пузырьки. При ультраструктурном исследовании портальных триад обнаруживаются междольковые артерии, вены, желчные протоки, а также лимфатические сосуды. Стенка междольковых артерий состоит из трех оболочек. Во внутренней оболочке находится сплошной пласт эндотелиальных клеток, расположенных на базальной мембране. В подэндотелиальном слое расположены малодифференцированные клетки, эластичные и коллагеновые волокна. В междольковых артериях хорошо выражена внутренняя эластическая мембрана. Средняя оболочка включает 1-2 слоя гладких миоцитов. Внешняя оболочка состоит из адвентициальних клеток. Вокруг артерий расположены фибробласты, коллагеновые и эластичные волокна. В просветах междольковых вен иногда оказываются моноциты и лимфоциты. В средней оболочке гладкие миоциты не образуют сплошного слоя, их внешняя оболочка состоит из рыхлой соединительной ткани, а в периваскулярном пространстве расположены фибробласты, коллагеновые и эластичные волокна, а также одиночные лимфоциты. Стенка междольковых желчных протоков состоит из кубических клеток с электронно-светлой цитоплазмой и ядрами. Вокруг желчных протоков находятся фибробласты, коллагеновые и эластичные волокна, а также единичные лимфоциты.
Через 8 недель развития экспериментального СД нами отмечено увеличение численности и размеров жировых включений в цитоплазме гепатоцитов и уменьшение включений гликогена (рис. 2).
Рис. 2. Печень крыс через 8 недель после введения стрептозотоцина. Сб. × 7000.
1 – отек эндотелиоцитов; 2 – сладж эритроцитов в просвете синусоида; 3 – гиперплазия коллагеновых волокон в перисинусоидальных пространствах.
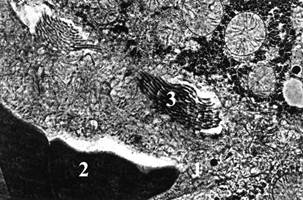
Возрастает число митохондрий и гетерогенность в структуре ядер. При этом встречаются сферические ядра со структурой хроматина и ядрышек, подобных интактным животным, но с увеличенной численностью гиперхромных ядер и конденсированным по краям хроматином. Перинуклеарные пространства вокруг таких ядер значительно расширены. Обнаруживаются гепатоциты с пикнотическими ядрами, которые имеют причудливую форму. Межклеточные пространства гепатоцитов видоизменены и расширены, в них выявляются коллагеновые фибриллы и фибробласты. Перисинусоидальные пространства расширены, заполнены коллагеновыми волокнами, среди которых обнаруживаются многочисленные фибробласты, звездчатые макрофагоциты и редко перисинусоидальные жиронакопительные клетки, в цитоплазме которых находятся гигантские удлиненные митохондрии червеобразной формы с многочисленными плотноупакованными кристами. Диаметры синусоидов сужены, часто встречается сладж эритроцитов, а также многочисленные звездчатые макрофагоциты и тромбоциты, которые контактируют с плазмолемой эндотелиоцитов. Эндотелиоциты в периферийной зоне утолщены. Их цитоплазма имеет неоднородную электронную плотность и содержит темные и светлые клетки, вакуоли, канальцы эндоплазматической сети, а также расширенные комплексы Гольджи и полиморфные митохондрии. Часто обнаруживаются просветленные митохондрии с деструктурированными кристами. Плазмолемальных везикул в таких клетках мало по сравнению с интактной группой животных. Ядра в эндотелиоцитах часто отечны, осмиофильные (рис. 3).
Рис. 3. Печень крыс через 8 недель после введения стрептозотоцина.
1 – сужение просветов синусоидов; 2 – утолщенные стенки синусоидов; 3 – базальная мембрана вокруг эндотелиоцитов.
Вокруг эндотелиоцитов обнаруживается базальная мембрана. В портальных трактах – выраженный склероз. Стенки артериол утолщены, эндотелиальная выстилка в них не сплошная. В средней оболочке наблюдаются процессы гипертрофии и гиперплазии гладких миоцитов. Стенка вен склерозирована и утолщена с наличием деструктивных фибробластов. Пространство желчных протоков расширено и заполнено остатками эпителиоцитов. Вокруг желчных протоков наблюдается гистиолимфоцитарная инфильтрация с отечными эндотелиоцитами и расширение диаметров лимфатических сосудов.
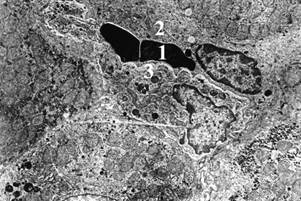
Через 10 недель эксперимента, наряду с вышеуказанными изменениями, отмечается увеличение числа деструктуризированых митохондрий и крупных жировых включений в гепатоцитах с уменьшением в них содержания гликогена (рис. 4).
Рис. 4. Печень крыс через 10 недель после введения стрептозотоцина. Сб. × 3000.
1 – деструкция митохондрий; 2 – выраженная жировая дистрофия цитоплазмы гепатоцитов.
Возрастает количество пикнотичных и формализованных ядер в гепатоцитах, расширяются их межклеточные и перисинусоидальные пространства и просветы в желчных капиллярах. Обнаруживаются разрастания коллагеновых волокон с гипертрофией и гиперплазией фибробластов. Возрастает численность снежных макрофагоцитов, суживаются синусоидальные капилляры и уменьшается численность перисинусоидальных жиронакопительных клеток. В них часто обнаруживается сладж эритроцитов и лейкоцитов. Эндотелиальные клетки в стенке синусоидных капилляров полиморфны. Их цитоплазма неоднородна с малым количеством органелл и деструктироваными митохондриями. Ядра часто выступают в просвет синусоидов, в них наблюдается маргинальная агрегация хроматина, ядрышки не определяются. Вокруг зоны органелл часто образуется базальная мембрана. В портальных трактах наблюдается склероз и гиперплазия фибробластов. При этом стенки междольковых артерий утолщены и склерозированы, в их просветах часто появляются пристеночные тромбы. Диаметры междольковых желчных протоков расширены, их стенки утолщены, лимфатические сосуды расширены.
Таким образом, на поздних этапах развития экспериментального СД происходят изменения в артериолах, характеризующиеся деструкцией эндотелиоцитов, гипертрофией и гиперплазией гладких миоцитов, сужением просвета и гиперплазией фибробластов в наружной оболочке артериол, а также гиперемией центральных и междольковых вен. В синусоидах, наряду с деструктивными изменениями в эндотелиоцитах, проходят процессы активации и увеличения численности макрофагоцитов и их миграция в перисинусоидальные пространства, что приводит к трансформации жиронакопительных клеток в фибробласты и разрастанию коллагеновых волокон. Расширение перисинусоидальных пространств приводит к утолщению барьера между кровью и гепатоцитами с последующим нарушением обмена веществ.
Рецензенты:
Матещук-Вацеба Л.Р., д.м.н., профессор кафедры нормальной анатомии Львовского национального медицинского университета им. Данила Галицкого, г. Львов.
Жилякова Е.Т., д.ф.н., профессор, зам. директора ООО «Асклепий», г. Белгород.
Источник