Кора головного мозга крысы препарат
Целью исследования явилось изучение клеточного состава и морфометрических показателей слоев переднетеменной зоны коры головного мозга половозрелых крыс-самцов.
Материалы и методы исследования
Исследования проводились на 20 белых беспородных половозрелых крысах-самцахмассой 200–250 г, на 8–10-й неделе постнатального онтогенеза. Животные забивались путем декапитации под наркозом смеси эфира с хлороформом (1:1) с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации, и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных.
Материалом для исследования служили участки коры головного мозга крыс, выделяемые согласно цитоархитектоническим картам [1;4].Фиксацию мозга осуществляли 10%-нымраствором формалина, приготовленном на 0,2 М фосфатном буфере, и смесью Карнуа. При отсутствии макроскопическивидимых повреждений органа делали продольный срез на уровне продолговатого мозга. Парафиновые срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином для обзорных целей, а для изучения цитоархитектоники – метиленовым синим по Нисслю.
Исследования препаратов проводились с помощью цифрового микроскопа MT 4000 SeriesBiologicalMicroscope с программным обеспечением для анализа изображений BioVisionVersion 4.0. Фотосъемку препаратов производили с помощью встроенной цифровой камеры при увеличении 10×10, 40×10 и 100×10.Разрешение полученных изображений1280×1024 пикселей.
Результаты исследования и их обсуждение
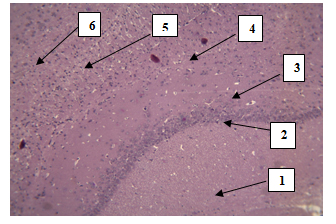
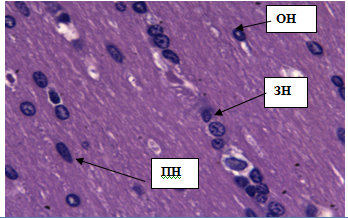
При гистологическом исследованиинеокортексабелой крысы обнаружено 6 слоев нервных клеток, снаружи внутрь располагающиеся в следующем порядке:1)молекулярный слой; 2) наружный зернистый слой; 3) наружный пирамидный слой; 4) внутренний зернистый слой; 5) внутренний пирамидный слой; 6) полиморфный слой (рис. 1).
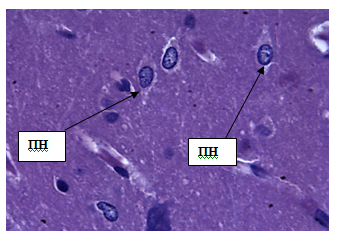
Исследования показали, что молекулярный слой содержит редкие нейроны слегка вытянутой или овальной формы диаметром 4,19±0,51 мкм. Средняя площадь клетки составляет 21,07±1,19 мкм. Нейроны содержат мелкие ядра площадью 8,24±0,53 мкм2 и диаметром 1,36±0,23 мкм. Цитоплазма клетки имеет мелкозернистую структуру. Основной объем молекулярного слоя составляют отростки – аксоны и дендриты. Толщина слоя составляет 88,44±0,94 мкм (рис. 2, табл.1).
Рис. 1.Кора больших полушарий головного мозга крыс.Окраска гематоксилином и эозином. Стрелками обозначены слои нервных клеток (снизу вверх: 1–молекулярный; 2-наружный зернистый; 3-наружный пирамидный; 4-внутренний зернистый; 5-внутренний пирамидный; 6-полиморфный). Ув. 10×10
Рис. 2. Молекулярный слой коры больших полушарий. Стрелкой обозначены нейроны молекулярного слоя коры больших полушарий (НМС). Окраска гематоксилином и эозином. Ув. 100×10
Наружный зернистый слой образован крупными нейронами диаметром 10,11±0,43 мкм, имеющими округлую и пирамидальную форму. Средняя площадь клеток 74,58±1,92 мкм2. Нейроны содержат ядра слегка вытянутой или овальной формы площадью 22,47±0,91 мкм2и диаметром 4,69±0,44 мкм. Цитоплазма клетки имеет крупнозернистую структуру. Клетки расположены плотно, образуя четко отделяющийся слой,толщиной 62,81±0,46 мкм (рис. 3, табл.1).
Наружный пирамидный слой представлен немногочисленными пирамидными нейронами конической формы площадью 27,14±0,67 мкм2, диаметром 6,87±0,48 мкм. Нейроны содержат мелкие ядра, имеющие округлую форму. Средняя площадь ядер слоя составляет 8,82±0,47 мкм2, диаметр 4,14±0,39 мкм.Цитоплазма клеток имеет гладкую, незернистую структуру. Толщина слоя 119,18±1,74 мкм (рис. 4, табл.1).
Рис. 3. Наружный зернистыйслой коры больших полушарий. Стрелкой обозначены нейроны наружного зернистого слоя (НЗК). Окраска гематоксилином и эозином. Ув. 100×10
Рис. 4. Наружный пирамидный слой коры больших полушарий. Стрелками обозначены пирамидные нейроны (ПН). Окраска гематоксилином и эозином. Ув. 100×10
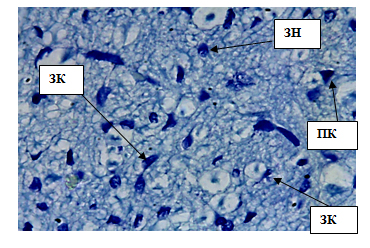
Внутренний зернистый слой содержит мелкие звездчатые клетки площадью 31,60±1,14 мкм2 и диаметром 5,93±0,43 мкм. Ядра перикарионов округлой формы, имеют четко выраженную структуру. Средняя площадь ядер 8,82±0,47 мкм2, диаметр 2,18±0,32 мкм. Цитоплазма в клетке распределена равномерно, без крупных белковых включений. Толщина слоя 664,38±0,66 мкм (рис. 5, табл.1).
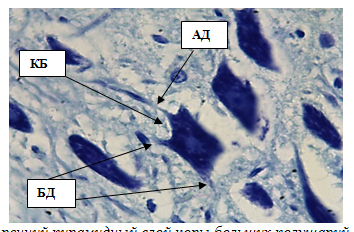
Внутренний пирамидный слой представлен крупными нейронами (клетки Беца, клетки Мейнерта) и небольшим количеством звездчатых клеток. Клетки Беца самые крупные нейроны коры площадью 149,31±1,18 мкм2 и диаметром 13,66±0,89 мкм, которые дают начало миелиновым волокнам пирамидного тракта.
Рис. 5. Внутренний зернистый слой коры больших полушарий. Стрелкой обозначены звездчатые клетки (ЗК), пирамидные клетки (ПК), зернистые нейроны(ЗН). Окраска метиленовым синим по Нисслю. Ув. 100×10
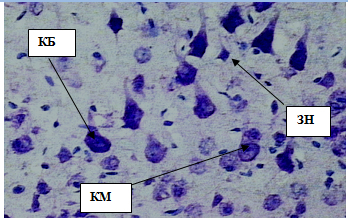
Цитоплазма не содержит включений, ядра крупные, площадью 28,83±0,61 мкм2, диаметром 6,34±0,57 мкм. Клетки Бецаимеют длинный апикальный дендрит, выходящий из вершины пирамиды в вышележащие слои, и другие дендриты, отходящие сбоку и от основанияперикариона. От основания пирамиды отходит аксон, уходящий в белоевещество(рис. 6, табл.1). Клетки Мейнерта – достаточно крупные нейроны, локализованные на протяжении всего V слоя коры полушарий.Средняя площадь клеток 86,13±0,96 мкм2, диаметр 9,23±0,40 мкм. Клетки имеют пирамидную форму, однако по сравнению с клетками Беца лишены крупных апикальных и боковых дендритов, ихядра относительно крупные, округлые, площадью 16,59±0,67 мкм2. Средняя толщина внутреннего пирамидного слоя составляет 285,61±0,99 мкм. Перикарионы звездчатых нейронов имеют округлую, полигональную или треугольную форму, 9–14 мкм в диаметре (рис. 7).
Полиморфный слой образован множеством нейронов различной величины и формы, а также некоторым количеством пирамидных и зернистых нейронов (рис.8). Клетки располагаются цепочками. Пирамидные нейроны имеют слегка вытянутую форму с заметными удлинениями, площадь которых 71,97±1,55 мкм2.Ядра небольшие с ровной структурой, площадью 11,83±0,45 мкм2. Зернистые нейроны имеют округло-угловатую форму размером от 74–77 мкм. Цитоплазма с крупными белковыми включениями, придающими зернистость внутреннему содержимому клетки. Ядра клеток вытянутые, площадью 16,08±0,92 мкм2, диаметром 5,15±0,36 мкм.
Рис. 6. Внутренний пирамидный слой коры больших полушарий. Стрелками обозначены:клетки Беца (КБ), апикальный дендрит (АД), боковые дендриты (БД). Окраска метиленовым синим по Нисслю.Ув. 100×10
Рис. 7. Внутренний пирамидный слой коры больших полушарий. Стрелками обозначены:клетки Беца (КБ), клетки Мейнерта (КМ), звездчатые нейроны (ЗН). Окраска метиленовым синим по Нисслю. Ув. 40×10
Морфометрические показатели нейронов коры головного мозга
Источник
Кора головного мозга крысы препарат
Каждый вид памяти (сенсорная, кратковременная и долговременная) с функциональной точки зрения обеспечивается мозговыми процессами разной сложности и механизмами, связанными с деятельностью различных систем мозга, которые связаны как структурно, так и функционально. Гиппокамп и ассоциативный таламус относят к неспецифическому уровню регуляции процессов памяти [4]. Латеральная часть медиодорсального ядра таламуса относится к ассоциативным ядрам таламуса. Различные поля гиппокампа (СА1 и СА3) могут в разной степени участвовать в процессах приобретения и консолидации следов памяти в зависимости от вовлечения разных нейромедиаторных систем. По мнению О.С. Виноградовой, поле СА3 является компаратором, сравнивающим наличную и предшествующую информацию, а поле СА1 – селектором, осуществляющим избирательный пропуск информации на запись в память [2]. Фармакологическое воздействие на гиппокамп правого полушария у крыс сильнее нарушает процессы обучения и запоминания по сравнению с воздействием на левый, но введение фармакологического вещества в гиппокамп левого полушария дает более выраженный эффект и стимулирует двигательную активность [9]. Установлена межполушарная асимметрия в реагировании нейронов поля СА3 на эмоциональное воздействие: в гиппокампе левого полушария при отрицательном эмоциональном напряжении было в 2 раза больше активных нейронов по сравнению с гиппокампом правого полушария [5]. Аммонов рог считается одним из наиболее важных морфологических субстратов для выбора активной или пассивной стратегии поведения при негативных эмоциональных воздействиях или в условиях дефицита информации. Асимметрия в гиппокампе и асимметрия в неокортексе находятся в реципроктных отношениях: при активных двигательных реакциях усиливается правостороннее влияние гиппокампа и левостороннее коры, при затаивании – более активны гиппокамп левого и кора правого полушарий [7]. В некоторых ядрах таламуса лабораторных животных также отмечается асимметрия по отдельным показателям [1, 6]. Несмотря на многочисленные исследования о роли ядер таламуса и гиппокампа правого и левого полушарий в жизнедеятельности организма, вопрос о структурных основах функциональной межполушарной асимметрии остается открытым. Большинство работ выполнены на анатомическом уровне с помощью позитронно-эмиссионной, магнитно-резонансной или компьютерной томографии. Исследования ядер таламуса и гиппокампа правого и левого полушарий на тканевом, клеточном, ультраструктурном и молекулярном уровнях являются единичными.
Цель – определить морфологические особенности нейронов латеральной части медиодорсального ядра таламуса и гиппокампа правого и левого полушарий крысы белой.
Материал и методы исследования
Объекты исследования – крысы белые (36 особей). Идентификацию морфологических структур (латеральная часть медиодорсального ядра и поля гиппокампа) проводили с помощью стереотаксического атласа мозга взрослой крысы G. Paxinos, Ch. Watson [10]. Лабораторные животные содержались в виварии в условиях, регламентированных приказом МЗ СССР № 1179 от 10.10.1983 года. Исследования проводились в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.77 № 755) и рекомендациями Международного комитета по науке о лабораторных животных, поддержанных ВОЗ. Головной мозг фиксировали в жидкости Карнуа в течение 2–2,5 часов, подвергали гистологической проводке в спиртах возрастающей концентрации и заключали в парафин. На микротоме изготавливали срезы толщиной 5–7 мкм, с помощью жидкости Апати срезы наклеивали на предметные стекла толщиной 1,0–1,2 мм. Рассматривали только нейроны с сохранной структурой, у которых четко определялось ядрышко. Полученные при работе количественные данные обработаны с помощью общепринятых в медико-биологических исследованиях методов статистического анализа с использованием программ «Microsoft Exсel» и «Statistica 6.0». Анализ на нормальность распределения показал целесообразность использования параметрической статистики при изучении медиодорсального ядра крысы белой и непараметрической статистики при изучении гиппокампа [3, 8].
Результаты исследования и их обсуждение
Нейроциты медиодорсального ядра правого полушария головного мозга были вытянутой или округлой формы с ядром, расположенным ближе к периферии. В ядре имелось одно базофильное ядрышко. Встречались единичные нейроны, содержащие два ядрышка. Численная плотность нейронов составила 598,9 ± 29,6/мм2. Преобладающее большинство нервных клеток медиодорсального ядра правого полушария головного мозга являлись нормохромными – 65,1 ± 1,2, гипохромными – 4,8 ± 1,1, гиперхромными – 24,5 ± 0,7, тотально-гиперхромными – 5,2 ± 0,9, клетки-тени (0,1 ± 0,3) и сморщенные нейроциты (0,3 ± 0,7) составляли группу клеток с необратимыми изменениями вещества Ниссля.
Видимых отличий по форме и размерам нейронов медиодорсального ядра в левом полушарии по сравнению с правым не наблюдалось. Площадь цитоплазмы преобладала над площадью ядра. Численная плотность составила 577,4 ± 24,1/мм2. Распределение нейронов медиодорсального ядра левого полушария головного мозга по степени хромофилии их цитоплазмы имело полиморфную картину: нормохромные – 67,2 ± 0,9, гипохромные – 4,6 ± 0,7, гиперхромные – 23,3 ± 1,3, тотально-гиперхромные – 4,8 ± 0,9, сморщенных нейронов было 0,1 ± 0,3.
У крысы белой наблюдалось преобладание численной плотности нейронов медиодорсального ядра в правом полушарии головного мозга (р
Источник
Кора головного мозга крысы препарат
Авторы: Г. А. Пьявченко 1,2 , В. А. Пугач 3 , Н. С. Новикова 3 , Л. И. Шмаркова 4 , Е. А. Корнева 3 , В. И. Ноздрин 1,2
1 Кафедра гистологии, цитологии и эмбриологии (зав. – проф. В. И. Ноздрин), Медицинский институт, Орловский государственный университет имени И. С. Тургенева;
2 Научный отдел (руков. – канд. биол. наук Г. В. Трунова), Фармацевтическое научно-производственное предприятие «Ретиноиды», Москва;
3 Отдел общей патологии и патофизиологии (зав. – д.б.н. О. В. Шамова), ФГБНУ «Институт экспериментальной медицины»;
4 Кафедра математики, информатики и информационных технологий (зав. – проф. Л. И. Малявкина), Орловский государственный университет экономики и торговли.
Резюме
Выявление c-Fos позитивных нейронов в различных участках головного мозга и изучение поведенческих реакций лабораторных крыс в условиях накожного нанесения пасты с содержанием 5% антисептика-стимулятора Дорогова 3 фракции показало активацию нейронов цингулярной, моторной, пириформной коры и стриатума, увеличение двигательной и ультразвуковой активности, а также продемонстрировало наличие корреляционной зависимости поведенческих реакций от активации нейронов в изучаемых зонах мозга. Результаты свидетельствуют о совместной регуляции поведения многими структурами мозга и о наличии у Препарата нейротропного эффекта.
Ключевые слова: цингулярная, моторная, пириформная кора, стриатум, антисептик-стимулятор Дорогова, c-Fos, поведенческие реакции.
Упоминания об антисептике-стимуляторе приходятся на первую половину прошлого века, когда он был получен А. В. Дороговым путем глубокого термического разложения тканей животных (АСД). По результатам проведенных исследований на животных и человеке был описан широкий положительный фармакологический эффект, охватывающий в том числе заболевания кожи (экзема, нейродермит, псориаз, аллергодерматозы и др.). При этом отмечен общий стимулирующий эффект на нервную систему [3]. Фармакологическая характеристика фракций препарата подтверждала данные о влиянии АСД на нервную систему, указывая на мускарино-, никотино- и холиномиметический эффект от нанесения препарата [1]. Морфологические проявления этого эффекта изучены не были. Известно, что поведенческие акты регулируются взаимодействием многих структур мозга. Основываясь на данных литературы [16, 21], были выбраны следующие функциональные зоны мозга: цингулярная кора – ответственна за сложные поведенческие реакции и ультразвуковые вокализации, моторная – регулирует четкие, избирательные движения, лежащие в основе поведения, соматосенсорная – чувствительность от большинства рецепторов тела, инсулярная – ответственна за процесс принятия решений, эмоциональный контроль за поведением и является центром регуляции зависимости от наркотических веществ, пириформная кора ответственна за эмоциональный контроль за поведением и стриатум, который участвует в регуляции сложных поведенческих актов, в работе внутренних органов. Для гистологической оценки степени активации нейронов мозга в настоящее время используют определение содержания белка c-Fos (маркер ранней нейральной активации) [8, 10, 11, 20].
Целью настоящего исследования стало изучение морфологических изменений нервных клеток в коре и стриатуме головного мозга крыс после накожного нанесения цинковой пасты с 5% АСД 3 фракции (Препарат). В связи с этим были поставлены следующие задачи:
- Дать морфологическую характеристику изменений коры и стриатума головного мозга крыс при накожном нанесении Препарата;
- Проанализировать особенности поведенческих реакций крыс при накожном нанесении Препарата;
- Проследить в этих условиях наличие корреляционных связей между активацией нейронов коры и стриатума и поведенческими актами животных после накожного нанесения Препарата.
Материалы и методы
Исследование проводили на крысах-самцах линии Sprague Dawley массой 100-120 г. (n=6 в группе), полученных из питомника филиала ИБХ РАН «Пущино». Животных содержали в условиях вивария Центра доклинических исследований АО «Ретиноиды». Основные правила содержания и ухода за крысами соответствовали правилам по устройству, оборудованию и содержанию вивариев [4]. Процедуры по уходу за животными выполняли в соответствии со стандартными операционными процедурами. Крысы находились в контролируемых условиях окружающей среды и получали полнорационный гранулированный комбикорм и очищенную воду без ограничений. Перед исследованием животных помещали в отдельное помещение на период адаптации в течение 14 дней. После рандомизации и идентификации крыс разделяли на следующие группы: группа 1 – интактные животные; группа 2 – животные, получавшие основу препарата (цинковая паста) и группа 3 – животные, получавшие Препарат. Животным 2 и 3 групп выбривали участок межлопаточной области спины площадью 4 см 2 . Основу и препарат в дозе 2 г/кг наносили 2 раза в сутки в течение 7 дней. Через 2 часа после последнего нанесения в течение 15 минут проводили запись двигательной активности, ультразвуковых вокализаций (УЗВ) и надпороговых криков на синхронизированном по времени комплексе Laboras-Sonotrack (Metris, Нидерланды) [6]. В дальнейшем животных наркотизировали препаратом Золетил 100 (Virbac, Франция). После интракардиальной перфузии иммунофикса (Bio-Optica, Италия) головной мозг фиксировали в течение часа и переносили в 15% раствор сахарозы на иммунофиксе. Срезы толщиной 40 µm получали на микротоме Thermo Scientific HM430 (Microm GmbH, Германия) с устройством быстрого замораживания KS 34. C-Fos-позитивные (активированные) клетки выявляли авидин-биотиновым методом с детекцией 3,3’-диаминобензидином (Santa Cruz, США).
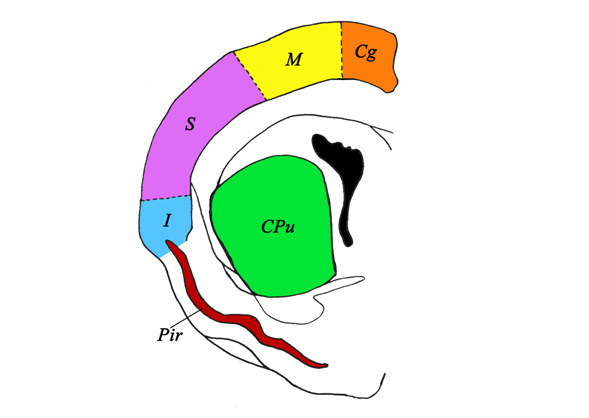
Объектами исследования служили цингулярная, моторная, соматосенсорная, инсулярная, пириформная кора и стриатум (Рис. 1), соответствующие 13-17 уровням срезов мозга по атласу Paxinos and Watson [15]. Подсчёт c-Fos-позитивных клеток проводили в 3 полях зрения для каждого животного (об. 40, ок., 20) при помощи программного обеспечения AxioVision (Carl Zeiss, Германия) на микроскопе Axioskop 2 (Carl Zeiss, Германия). Статистический анализ достоверности различий средних величин (M±m, t-критерий Стьюдента), а также анализ корреляционной зависимости поведенческих реакций от количества нейронов (коэффициент корреляции r) проводили с помощью программы Statistica, версия 6,1 [7].
Результаты исследования
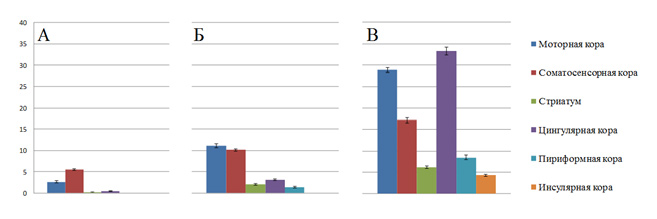
Экспрессия гена c-Fos была выявлена в фоновом количестве у крыс из 1-й группы. У животных из 2-й группы наблюдалось большее количество c-Fos-позитивных нейронов, в особенности – в моторной и соматосенсорной коре. Крысы, получавшие Препарат, показали резкое увеличение количества активированных нейронов во всех исследуемых зонах (рис. 4), особенно, в цингулярной, моторной, пириформной коре и стриатуме (рис. 2-3). Результаты анализа поведенческой активности крыс после применения Препарата демонстрируют увеличение продолжительности и скорости движения, пройденного расстояния, а также общего количества зарегистрированных поведенческих актов (табл. 1). Анализ показателей УЗВ показал, что крысы из 3-й группы издают ультразвуков больше и ниже – по частоте (табл. 2). Корреляционный анализ в группе животных, получавших Препарат, выявил наличие достоверной зависимости между числом c-Fos-позитивных нейронов и поведенческой активностью крыс (табл. 3).
Обсуждение полученных данных
В настоящем исследовании обнаружена связь между активацией нейронов моторной, пириформной коры и стриатума головного мозга крыс и их средней скоростью движения, что подтверждает наличие кортико-стриальных и кортико-кортикальных взаимодействий головного мозга. Эти данные согласуются с результатами исследований на лабораторных грызунах, обобщенных в монографии C. Watson, G. Paxinos и L. Puelles [21]. Наличие подобных связей в своих работах описывают и другие авторы [13, 19]. Корреляционный анализ выявил наличие связи между количеством активированных нейронов моторной, пириформной коры и стриатума и двигательной активностью лабораторных крыс. Этот факт подтверждает многочисленные литературные данные о связях коры и подкорковых ядер головного мозга в осуществлении двигательных актов и их регуляции [2, 5, 12, 14]. В работе показано, что накожное нанесение Препарата сопровождается активацией нейронов стриатума, цингулярной, моторной и пириформной коры и изменением в поведении. A. Sayin и др. [18] в своем исследовании отмечают, что введение крысам-самкам циталопрама коррелирует с тревожным поведением и увеличением содержания c-Fos позитивных нейронов в цингулярной коре, миндалевидном теле и паравентрикулярном таламическом ядре. О том же говорят результаты исследования O. Babaev и др. [9], согласно которым, воздействие на белки нейролигины приводит к активации c-Fos-позитивных нейронов в зонах, ассоциирующихся с тревогой.
В нашем исследовании выявлена корреляционная связь между количеством c-Fos-позитивных нейронов цингулярной коры и параметрами ультразвуковых вокализаций в группе животных, получавших Препарат. В статье S. S. Pertsov и др. [17] также отмечено, что различные эмоциональные состояния у крыс сопровождаются изменениями параметров УЗВ, регистрируемых комплексом Sonotrack. Увеличение содержания индуцибельного белка c-Fos в соматосенсорной и инсулярной коре свидетельствует об активации нейронов в ответ на процесс накожного нанесения Препарата и связанными с этим ощущениями.
Заключение
Нанесение цинковой пасты с 5% АСД 3 фракции на кожу межлопаточной области крыс линии Sprague Dawley приводит к значительному увеличению числа активированных, c-Fos-позитивных нейронов в цингулярной, моторной, инсулярной и пириформной коре, а также – в полосатом теле головного мозга и к увеличению двигательной и ультразвуковой активности крыс. Результаты корреляционного анализа позволяют говорить о высокой степени вероятности наличия связи между количеством активированных нейронов и поведенческой активностью животного.
| Показания прибора Laboras | ||||
|---|---|---|---|---|
| Группы | Продолжительность двигательных актов, сек | Средняя скорость движения, мм/с | Пройденное расстояние, м | Общее количество поведенческих актов |
| Интактные животные | 6,5±2,7 | 0,4±0,2 | 0,3±0,2 | 155±33,5 |
| Основа | 40,2±1,2 * | 2,9±0,4 * | 2,6±0,3 * | 329,7±15,2 * |
| Цинковая паста с 5% АСД-3 | 74,5±10,5 *, # | 6,5±0,7 *, # | 5,9±0,6 *, # | 413,3±13,1 *, # |
* P≤0,05, по сравнению с 1 группой
# P≤0,05, по сравнению со 2 группой
| Показания прибора Sonotrack | |||
|---|---|---|---|
| Группы | Количество криков | Количество надпороговых криков | Средняя частота криков, Гц |
| Интактные животные | 9,3±4,2 | 0 | 49364±47,4 |
| Основа | 6,7±1,5 | 1,7±0,7 * | 49190,7±149,6 |
| Цинковая паста с 5% АСД-3 | 49,3±7,4 *, # | 19±4,9 *, # | 48512,3±78 *, # |
* P≤0,05, по сравнению с 1 группой
# P≤0,05, по сравнению со 2 группой
| Зоны головного мозга | Параметры поведения | Коэффициент корреляции (r) |
|---|---|---|
| Моторная кора | Средняя скорость движения, мм/с | 0,92 |
| Стриатум | 0,92 | |
| Пириформная кора | 0,92 | |
| Цингулярная кора | Крики | 0,94 |
| Средняя частота криков, Гц | -0,92 * | |
| Надпороговые крики | 0,91 |
* – указывает на обратную корреляционную зависимость.
Рис 1. Схема строения коры и стриатума правого полушария головного мозга крысы. Фронтальный срез на 13-17 уровнях. Обозначения структур, в которых выявлены c-Fos-позитивные нейроны: цингулярная (cingularis) – Cg; моторная (motorius) – M; соматосенсорная (somatosensorius) – S; инсулярная (insularis) – I; пириформная кора (cortex piriformis) – Pir и стриатум (corpus striatum) – CPu. Рисунок Сень Е. В.
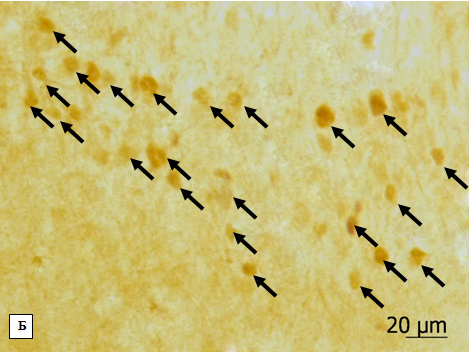
Микрофотографии фрагментов моторной коры крыс из 2-й (А) и 3-й групп (Б) эксперимента, c-Fos-позитивные клетки разной интенсивности окраски указаны стрелками. Об. 40х, ок. 20х.
Микрофотографии фрагментов пириформной коры крыс из 2-й (А) и 3-й групп (Б) эксперимента, c-Fos-позитивные клетки разной интенсивности окраски указаны стрелками. Об. 40х, ок. 20х.
Рис 4. Количество c-Fos позитивных клеток в п. з. коры головного мозга и базальных ядер (стриатум) интактных крыс (А); крыс, получавших основу (Б) и крыс, получавших цинковую пасту с 5% АСД-3 (В). По оси ординат – среднее количество активированных нейронов в поле зрения (M), вертикальными отрезками столбиков обозначена стандартная ошибка среднего (m).
Источник