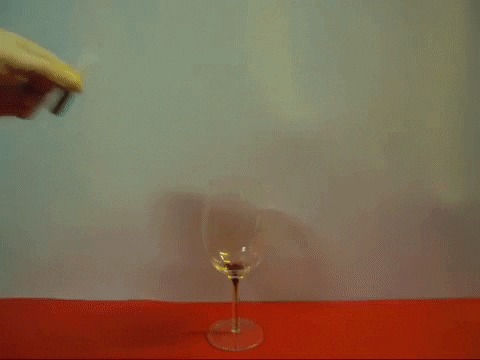- Крот фольга как сделать
- —>СТАТИСТИКА —>
- —>МЫ ВКОНТАКТЕ —>
- —>НЕМНОГО РЕКЛАМЫ —>
- Наши спонсоры
- Как сделать водородную свечу из подручных материалов
- Крот и фольга
- Вулкан Бёттгера. Эксперимент. (запись №6)
- Фараоновы змеи. Эксперимент (запись №5)
- Вот что происходит с таблетками глюконата кальция при нагревании
- Получаем натрий из ВОДНОГО раствора
- Карманное пособие по анодированию. )))
- Электроны. Свойства. Опыты
- Изотопы водорода
- Пять красивых опытов, которые вы можете провести дома вместе с детьми
- ФотоХимическая реакция. H2 + Cl2
- Что такое нитрат аммония, из-за которого произошел взрыв в Бейруте?
- Иод в гифках
- Учительница года
- Бром в гифках
- Бор в гифках
- Хеллоуин + химия
- Фосфор в гифках
- Буууууум!
- Ода человеческой тупости или как взвод дураков город взорвал.
Крот фольга как сделать
Эрнест Резерфорд занимался исследованиями в основном в области физики и однажды заявил, что «все науки можно разделить на две группы — на физику и коллекционирование марок». Однако Нобелевскую премию ему вручили по химии, что стало неожиданностью как для него, так и для других учёных. Впоследствии он замечал, что из всех превращений, которые ему удалось наблюдать, «самым неожиданным стало собственное превращение из физика в химика».
—>СТАТИСТИКА —>
—>МЫ ВКОНТАКТЕ —>
—>НЕМНОГО РЕКЛАМЫ —>
Наши спонсоры

Описание:
Для опыта нам понадобились: NaOH (он же «гидроксид натрия», он же «едкий натр», продается в магазинах, как средство очистки труб «Крот» или др.); вода; алюминий в любом виде (фольга, проволока, алюминиевая банка от кока-колы и т.д.); колба для раствора (подойдет и бутылка); емкость для охлаждения; резиновый шарик.
Насыпаем в колбу небольшое количество едкого натра и заливаем 50 -100 мл воды, перемешиваем раствор до полного растворения кристаллов. Далее добавляем несколько кусочков алюминия. Сразу же начнется реакция с выделением водорода и тепла, сначала слабая, но постоянно усиливающаяся. Т.к. раствор в колбе очень сильно разогревается (начинает даже кипеть), мы опускаем колбу в емкость с водой для охлаждения. На горлышко колбы надеваем шарик для сбора водорода.
Шарик достаточно быстро наполняется водородом, который выделяется в процессе химической реакции. Главное, следить за тем, чтобы реакция не шла слишком бурно, иначе будет выделяться много паров воды внутрь шарика, что делает его тяжелым.
Как образуется водород?
Объяснение:
Алюминий ‑ активный металл, однако из-за прочной оксидной пленки его активность мало заметна. Алюминий не реагирует с водой только лишь потому, что на поверхности металла плотная пленка оксида.
Оксидная пленка, покрывающая поверхность алюминия, при контакте с щелочью разрушается. Так как алюминий является активным металлом, то он начинает реагировать с водой, растворяясь в ней, при этом выделяется водород.
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Можно также проверить, будет ли действовать вода (без щелочи) на освобожденный от оксидной пленки алюминий. Удалим щелочь и промоем поверхность металла. Свободный от оксидной пленки алюминий реагирует с водой. Выделяется водород и образуется нерастворимый гидроксид алюминия.
2Al + 6H2O = 2Al(OH)3↓ + 3H2↑
Вывод:
Из опыта мы увидели, что если нарушить плотную естественную оксидную пленку алюминия, он легко разрушается даже в воде. Поэтому алюминиевую посуду не рекомендуется чистить средствами, содержащими щелочь, так как при этом алюминиевые изделия быстро теряют привлекательность, а в посуде из алюминия быстро образуются дырки.
В результате мы получили шарик с водородом, который в 14 раз легче воздуха. Такой шарик можно запустить с друзьями на улице, прикрепив к нему записку или корзинку с воздухоплавателем.
Острожно. Водород взрывоопасен!

1) Не проводите данный опыт без присутствия взрослых и рядом с открытым пламенем!
2) Не проводите данный опыт в закрытом помещении!
– водород быстро поднимается под потолок и скапливается там, образуя при смешении с воздухом взрывоопасный слой гремучего газа.
Источник
Как сделать водородную свечу из подручных материалов
Все мы прекрасно знаем, что водород — весьма эффективное топливо. Причём настолько, что его давно уже добывают в промышленных масштабах и переоборудуют многие двигатели специально под него. Но есть ли у него менее масштабное применение? Да такое, при котором особо напрягаться не приходилось бы? Да, есть. Например, простейшая водородная свеча.
В чём, собственно, дело. Водород под действием высоких температур взрывается. Но если струйка газа достаточно тонкая да и присутствует постоянная тяга, то критической массы не набирается и происходит медленное горение. Именно на этом принципе и основана водородная свеча. Но сразу уточняем: любая ошибка в эксплуатации и подготовке — и водород взорвётся. Взрыв, к счастью, будет небольшим, но обжечь кожу может. Так что работать нужно очень аккуратно.
- Стеклянная банка с крышкой
- Средство для прочистки труб «Крот»
- Металлическая трубочка
- Фольга
- Вода
Мы будем проводить простейшую химическую реакцию — взаимодействие щёлочи и алюминия в водной среде. Говоря языком формул:
Где Al — наша фольга, NaOH — гидроксид натрия, основной компонент смеси «Крот», а H2 — тот самый водород, который нам и нужен. Как же это выглядит на практике.
В стеклянную банку засыпаем «Крот» и заливаем его водой, тщательно перемешивая. Делать это нужно аккуратно, чтобы не дай бог ни одна капля щёлочи не попала к вам на руки — вам же не нужен неприятный ожог, который плохо заживает? Ну вот. Далее берём фольгу, рвём её на отдельные куски и комкаем их. Все эти шарики закидываем в щёлочь и закрываем банку крышкой (металл или пластик — всё равно), с предварительно прорезанным отверстием и вставленной туда металлической трубочкой (в некоторых рекомендациях трубочку не используют, так что огонь получается сильнее, но менее контролируемым). Собственно, всё.
Водород будет выделяться достаточно медленно, поэтому большого взрыва произойти не должно. Но этого потока хватит, чтобы обеспечить небольшой огонёк в течение довольно большого времени. Да, это не слишком ярко. Да, читать при таком освещении не получится. Да, пламя не будет слишком стойким — задуть его не сложно. Но работать водородная свеча будет очень долго, чем значительно превосходит обычные свечи. Да и нагреть на ней что-то очень даже реально. Плюс когда реакция прекратиться, нужно будет просто добавить воды или фольги.
И ещё несколько советов из техники безопасности. Никогда не открывайте крышку, пока огонь горит — будет небольшой взрыв. Всегда герметизируйте края между металлической трубочкой и крышкой — иначе водород будет выходить через неположенные места, а это тоже может привести ко взрыву. Работать над созданием водородной свечи лучше в защитных перчатках — они и от щёлочи защитят, и от ожога.
Источник
Крот и фольга
По-моему, предназначение slow motion всё же заключается в замедлении интересного события, а не ожидания оного.
Мотал видео, искал где выбегает крот =/
Срочно повторить используя 10л баклашку!

Новый способ уничтожение мусора,обматываешь фольгой, бросаешь в унитаз, заливаешь кротом. (▀̿Ĺ̯▀̿ ̿)
Вулкан Бёттгера. Эксперимент. (запись №6)
Дихромат аммония — это соль, в состав которой входят окислитель и восстановитель. Поэтому «внутри» соли может пройти экзотермическая окислительно-восстановительная реакция.
Окислителем является хром ( VI ), который в результате реакции превращается в хром ( III ). В результате этого образуется зеленый оксид хрома.
Восстановитель — это азот, который входит в состав иона аммония. В результате реакции он превращается в газообразный азот.
(NH4)2Cr2O7 = N2 + 4H2O + Cr2 O 3
Немецким химиком Рудольфом Бёттером в 1843г. было получено оранжево-красное кристаллическое вещество — дихромат аммония (NH4)2Cr2O7.
Ученый решил провести опыты по способности вещества взрываться от удара и загораться от лучины. При ударе кристаллы дихромата аммония превратились в порошок.
После чего ученый поднес к горке порошка горящую лучину. Возгорания не произошло, но вокруг лучинки начали подпрыгивать раскаленные частицы вещества, а горка начала увеличиваться.
Также изменился ее цвет, он стал зеленым.
Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) и при взаимодействии с водой.
Металлы, стоящие в ряду правее водорода, с водными растворами кислот — неокислителей при обычных условиях не взаимодействуют.
Дихромат аммония до термической реакции (фото из интернета, не мое)
Фараоновы змеи. Эксперимент (запись №5)
Для опыта необходимы:
1) Глюконат кальция
2) Сухое горючее
4) Негорючая поверхность
Во время нагревания глюконата кальция, происходит реакция с выделением углерода, углекислого газа, оксида кальция и воды.
С12H22CaO14 + O2 = 10C + 2CO2 ↑ + СaO + 11H2O
Из-за выделения газа и происходит «рост».
«Фараоновы змеи» довольно хрупкие, достигают в длину около 15 см.
На «змеях» присутствует белый налет — это оксид кальция, образовавшийся в результате реакции.
Вот что происходит с таблетками глюконата кальция при нагревании
Получаем натрий из ВОДНОГО раствора
Как всем известно (ну тем, кто учил химию) получить щелочные металлы из водных растворов невозможно. По крайней мере так учат в школе. Речь идёт об электролитическом методе.
При этом в продолжении темы рассказывают об электролизе расплавов щелочей, из которых всё же можно выделить щелочные металлы в виде металлов.
В видео ниже вы увидите, как буквально на коленке можно организовать процесс электролиза расплава щелочей и получить металлический натрий. (готовьте салфетки, чтобы подтирать кровь из глаз)
А также продемонстрирован лайфхак, как получить щелочные металлы их ВОДНЫХ растворов их солей.
Карманное пособие по анодированию. )))
Электроны. Свойства. Опыты
Наконец смог собрать всевозможные газоразрядные трубки, чтобы поэкспериментировать с ними и продемонстрировать валам, какие же опыты ставили большее 100 лет назад такие ученые, как Уильям Крукс, Вильгельм Конрад Рентген и другие.
В этом видео поиграем с электронами ( будем толкать их магнитным полем), сделаем рентген нокии 3310 и ещё всякое по мелочи.
P.s.: дизайнер обложек занят, сдаёт ЕГЭ, поэтому пока слепил то, что получилось.
Изотопы водорода
Пять красивых опытов, которые вы можете провести дома вместе с детьми
Детей с раннего возраста нужно приучать к науке. Лучше всего для этого подойдут опыты — наглядные, интересные и приводящие к неожиданным для детей результатам. Мы подобрали пять научных и красивых экспериментов, которые можно провести в домашних условиях.
Зачастую родителям кажется, что научить детей чему-то, связанному с наукой, — просто сизифов труд. Конечно, можно предоставить эту нелегкую задачу интернету — вам на помощь придут Google и «Яндекс». Но рано или поздно придется разбивать сложные темы на уроки, которые ребенок сможет усвоить. Так что… Может, лучше оставить выполнение этой задачи профессионалам?
Как бы то ни было, вовсе необязательно, чтобы белый лабораторный халат — вдруг он у вас есть — пылился в шкафу. Вместе со своими детьми вы можете провести множество увлекательных и простых экспериментов, которые помогут им понять некоторые основные принципы научного мира.
Эксперимент № 1. Электромотор
Как помочь ребенку — или даже себе — понять силу магнитов? Попробуйте сделать электромотор! Для этого эксперимента вам понадобятся всего лишь одна пальчиковая батарейка (АА), магнит и немного медной проволоки.
Для начала прикрепите магнит к отрицательному полюсу батарейки — так, чтобы она могла твердо стоять на нем. Затем согните медную проволоку, чтобы получилось что-то в форме бабочки (можно и в форме сердца — главное, чтобы по двум сторонам от батарейки были примерно одинаковые «лопасти»). Также можно сделать небольшую вмятину на положительном полюсе батарейки, чтобы конструкция из проволоки держалась устойчивее. Наденьте конструкцию на батарейку так, чтобы свободные концы проволоки слегка касались магнита: у вас получится униполярный мотор или самоподдерживающийся двигатель, использующий противоположные магнитные поля.
Эксперимент № 2. Шагающаявода
Вода — удивительная субстанция, и вы в очередной раз сможете убедиться в этом, а заодно и удивить детей, в ходе этого эксперимента. Для него понадобятся восемь пластиковых стаканчиков (можно больше или меньше), вода, пищевой краситель разных цветов и бумажные полотенца (или салфетки).
Расположите стаканы в ряд, налейте немного воды в каждый второй, а затем добавьте в каждый краситель разного цвета. После сделайте несколько полосок из бумажных полотенец и поместите каждую из них в стаканы — одним концом в стакан с водой, другим — в пустой. В итоге вода постепенно переместится в пустые стаканчики, а в качестве бонуса вы получите интересную художественную инсталляцию.
Эксперимент № 3. Фейерверки в стакане
Вам потребуются вода, две столовые ложки растительного масла и пищевой краситель. Все это поможет узнать о весе разных жидкостей, а в процессе устроить «фейерверки».
Для начала добавьте немного красителя в масло, затем перелейте эту смесь в чашу с водой. Более легкое масло будет плавать поверх воды, а более тяжелый краситель начнет постепенно выбираться из своей маслянистой «темницы», при этом рисуя в воде занимательные узоры — своего рода фейерверки.
Эксперимент № 4. Один стакан, семь слоев
Еще один способ показать детям, что не все жидкости одинаковы. Вам понадобятся мед, кукурузный сироп, средство для мытья посуды, вода, растительное масло, медицинский спирт, масло для лампады и высокий сосуд (желательно не очень широкий).
Аккуратно налейте каждый из ингредиентов в сосуд в порядке, указанном выше. Так каждая из жидкостей займет свой слой, и они не перемешаются.
ФотоХимическая реакция. H2 + Cl2
Где-то год назад наткнулся на ютубе на старое советское видео про галогены. И там я обратил внимание на фотохимическую реакцию получения хлороводород из хлора и водорода. Зацепило меня то, что (как мне показалось) реакция там не показана. В фильме просто склейка. Ну как мне кажется. Поэтому мне было интересно провести эту реакцию самостоятельно и посмотреть на неё своими глазами. Ну и конечно же показать вам и рассказать про нюансы проведения данного эксперимента.
Приятного аппетита и просмотра!
Что такое нитрат аммония, из-за которого произошел взрыв в Бейруте?
Обычно это вещество используется в качестве сельскохозяйственного удобрения.
4 августа в столице Ливана прогремел мощнейший взрыв, в результате которого, по предварительным данным, погибло более 100 человек, и тысячи получили ранения.
Премьер-министр страны Хасан Диаб объявил, что взрыв был вызван детонацией 2700 тонн нитрата аммония или аммиачной селитры, хранившейся возле грузового порта Бейрута. Вещество находилось там с 2014 года, после того как его конфисковали с арестованного судна Rhosus.
Аммиачная селитра имеет химическую формулу NH₄NO₃. Это вещество, производимое в виде небольших пористых гранул, является одним из самых широко используемых в мире удобрений. Кроме того, нитрат аммония служит как компонент взрывчатки. В горнодобывающей промышленности до 70% управляемых взрывов производят с помощью селитры, где она смешивается с нефтесодержащим продуктом, например, с мазутом.
Однако, чтобы произошла катастрофа, подобная взрыву в Бейруте, многое должно было пойти не так. К сожалению, именно это и случилось в ливанской столице.
Сам по себе нитрат аммония не горит. Вместо этого, он действует как источник кислорода, который может ускорить горение других материалов.
Гранулы аммиачной селитры обеспечивают гораздо более концентрированный запас кислорода, чем воздух вокруг нас. Вот почему селитра так эффективна при производстве взрывчатых веществ.
Температура плавления нитрата аммония составляет 170 градусов по Цельсию. После этого, вещество начинает разлагаться. В результате этого процесса образуются газы, включая оксиды азота и водяной пар. Именно это быстрое выделение газов вызывает взрыв.
Разложение нитрата аммония может начаться, если произойдет взрыв там, где он хранится или если поблизости начнется сильный пожар. В чистом виде аммиачная селитра значительно уступает большинству взрывчатых веществ по энергии взрыва, однако ее взрывоопасность повышается с ростом ее влажности и при температурных перепадах, приводящих к перекристаллизации.
Сообщается, что 2700 тонн нитрата аммония хранились на складе в Бейруте в течение шести лет без надлежащего контроля безопасности. Это почти наверняка способствовало трагическим обстоятельствам, вызвавшим столь разрушительный взрыв.
Взрыв аммиачной селитры производит огромное количество оксидов азота. Диоксид азота (NO₂) — красный газ с неприятным запахом. Ролики из Бейрута показывают отчетливый красноватый цвет шлейфа газов от взрыва.
Джеффри Льюис, эксперт по ядерному оружию из Института международных исследований Миддлбери в Калифорнии, оценил мощность взрыва в Бейруте «от 200 до 500 тонн в тротиловом эквиваленте, учитывая ущерб от взрыва, ударную волну, сейсмические сигналы и размер воронки».
Взрыв в Бейруте — не единственная катастрофа, связанная с нитратом аммония. В августе 2015 года взрыв произошел в портовом городе Тяньцзинь в результате возгорания на складе логистической компании Ruihai. Тогда погибли 173 человека, восемь человек пропали без вести, 797 человек получили ранения.
Иод в гифках
Если ёмкость с газообразным иодом накрыть охлаждённой колбой, то кристаллы будут формироваться прямо на её стенке
Существует заблуждение, что у иода нет в принципе жидкого агрегатного состояния, однако его можно получить, если в пробирке с веществом поддерживать температуру между 114°C и 184°C
(или же нагревать иод в условиях повышенного давления)
Реакция иода с металлическим рубидием
Иод растворяется в воде плохо, но хорошо в неполярных растворителях (например в циклогексане)
Образование иодоформа при добавлении гидроксида натрия к спиртовой настойке йода
Термическое разложение пентаоксида дииода
Реакция порошка алюминия с пентаоксидом дииода при нагревании
Взрыв нитрида трииода от механического воздействия
Реакция трихлорида иода с декабораном
Смесь перекиси водорода и серной кислоты добавляют к смеси иодида калия, тиосульфата натрия и крахмала. Происходят реакции окисления иодида до иода и одновременное его же восстановления тиосульфатом обратно до иодида. Как только тиосульфат заканчивается и иодид перестает образовываться, раствор мгновенно темнеет из-за получившегося комплекса с крахмалом.
Предыдущие посты серии:
P.S. Элемент называется именно иод (иодиды, иодоводород, иодная к-та и пр.)
Йод — тривиальное название и в основном употребляется в значении спиртового медицинского раствора.
Учительница года
Бром в гифках
Бром (при нормальных условиях) — плотная и летучая жидкость
Реакция брома с алюминием
Реакция брома с металлическим натрием
Реакция брома с красным фосфором
Реакция брома с кремнием
Реакция брома с флуоресцеином (получение красителя эозина В)
Растворимость брома в неполярных растворителях выше, поэтому при добавлении толуола к водному раствору, он переходит в органический слой
Щёлочь нейтрализует раствор брома
Реакция смеси сахара и бромата калия с серной кислотой
Предыдущие посты серии:
Бор в гифках
Реакция чистого бора с литием при нагревании смеси
Взрыв смеси декаборана и бертолетовой соли от механического воздействия
Взрыв от реакции декаборана с азотной кислотой
Возгорание в кислороде декоборана, растворённого в сероуглероде
Горение декаборана в жидком кислороде
Реакция тетрагидридобората натрия с тетрахлоридом олова
Реакция тетрагидридобората калия с серной кислотой
Горение борной кислоты в метаноле
Предыдущие посты серии:
Хеллоуин + химия
Фосфор в гифках
Горение белого фосфора с образованием оксида фосфора (V)
Горение красного фосфора (более стабильной модификации элемента)
Кристаллы черного фосфора (форма, в которую переходит элемент при давлении в 20 тысяч атмосфер)
Разрезание ножом стержня из белого фосфора
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу.
(процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего)
Реакция красного фосфора с бромом
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C
Реакция красного фосфора с бертолетовой солью.
Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Чуть больше года назад вёл рубрику с подборками GIF об элементах, но что то потом забиыл.
Думаю стоит всё-таки продолжать начатое 🙂
Предыдущие посты серии:
Буууууум!
________________________________________________________________
Взаимодействие красного фосфора и бертолетовой соли.
Я химик, который по совместительству воспроизводит и разрабатывает различные демонстрационные опыты. Я занимаюсь этим уже очень давно и, наконец, я решил поделиться с вами частичками своей работы. Видео, на которых я что-либо делаю, присылают мне самые разные люди, самых разных возрастов. В связи с этим, они будут разного качества и по разному сняты, прошу, отнеситесь к этому с пониманием!
Эта реакция инициируется простым ударом шпателя, причем детонация происходит с существенной силой и может погнуть шпатель у вас в руках или выбить его из рук:
Если вы находитесь рядом то вам обеспечен звон в ушах после опыта.
Источник видео в моем инстаграме.
Ода человеческой тупости или как взвод дураков город взорвал.
Говорил я тут недавно с одним знатоком пива по имени @Urobeeros о ТБ и малоадекватных личностях. Между делом я вспомнил один случай из истории человечества, который иллюстрирует теорию Дарвина, причём приспособляемость у человека напрямую связана с кругозором.
Человечество на протяжении всей своей истории имеет дело с разрушением. Для того, чтобы разрушать эффективнее изобретаются всё новые методы и орудия. Но настоящим прорывом стало изобретение пороха, которое случилось много тысяч лет назад. Даже в Европе с дымным порохом знакомы многие сотни лет. Вот так выглядит выстрел из оружия, при использовании дымного пороха, думаю понятно, почему от него отказались, в пользу бездымного.
Все фото взяты из гугла.
В дальнейшем появлялись новые виды взрывчатки, но нас интересует именно чёрный порох, поскольку в его состав входит селитра, а именно нитрат калия. Селитры бывают разные, все они являются нитратами, то есть солями азотной кислоты и разных металлов или аммиака, и названия они носят по первой части: калийная селитра, бариевая и пр. Все они являются сильными окислителями, если утрировать, то поддерживают горение.
Затем, в 1863 году, изобретают тротил, а в 1899 аммонал. Про этих двоих, я думаю, слышал каждый из вас. Уточню, что аммонал — взрывчатое вещество в основе которого находится аммиачная селитра (секрета тут нет, состав аммонала без спецификаций можно даже на википедии прочитать), а для его детонации используют как раз тротил.
А теперь перейдём к самому соку истории. С 1865 года на нашей планете существует крупная (одна из крупнейших) химическая корпорация BASF. Начиналась она в Германии, и первые склады тоже были там. В числе прочего, компания производила аммиачную селитру, доподлинно неизвестно, для удобрений или военных целей (мои догадки, что второе, потому что для удобрений она нужна в гранулах, а военным — порошком). Хранилась селитра в танках, подобных этому.
Точные цифры я не нашёл (плохо искал), по данным русских источников там было от 4 до 12 тысяч тонн селитры, по немецким источникам, которые я смог прочесть — от 400 тонн. На самом деле точные цифры не так важны, достаточно сказать, что было её дофига, в чём вы скоро убедитесь. Утром 21 сентября 1921 года группа рабочих должна была вынести селитру со склада в городе Оппау на юге Германии, но она, за время хранения, основательно слежалась в плотный монолит. Умные работники (тут могла быть картинка со смекалистым парнем, вот настолько они умные) решили, что колоть многие сотни тонн монолита кирками им западло. Поэтому они набурили углублений и заложили в них тротил, дабы раздробить сразу весь монолит. Чуете, чем попахивает? Вот именно:
Все здания в Оппау были разрушены либо повреждены, сдуло с рельс трамваи, пострадали два соседних городка. В общей сложности пострадало несколько тысяч человек, 561 погиб. В 80-километровом радиусе выбило окна, а толчки землетрясения чувствовались в окрестностях Мюнхена и даже во Франции. Этот взрыв признан одной из крупнейших техногенных катастроф в истории мира. А всё из-за того, что разнорабочие были уверены, что лучше начальства всё знают, а кирками им работать сказали из вредности.
Кругозор расширять никогда не поздно и всегда полезно. Тогда подобных бед можно было бы избежать. Ведь те рабочие тоже могли знать про селитру и аммонал, ведь они же работали в этой компании, могли и нахвататься знаний, если бы было желание, и химики с рабочими общаются, и литература в доступе. Ну или хоть инструкцию ТБ могли запомнить.
Источник