Масса печени у крыс
Повышенная продукция глюкозы печенью в результате угнетения гликолиза и усиления глюконеогенеза является характерной чертой сахарного диабета (СД) 2 типа. Данные процессы – ответственные за гипергликемию у больных СД 2 типа натощак. В то же время рост концентрации глюкозы в крови после приема пищи (постпрандиальной гликемии) связан с торможением утилизации глюкозы периферическими тканями, в первую очередь мышцами [1]. Это обусловлено нарушением синтеза гликогена в результате снижения активности гликогенсинтетазы и ослабления процессов окисления глюкозы вследствие дефекта в пируватдегидрогеназном комплексе. Свой вклад в данный процесс вносят изменения в секреторной функции панкреатических бета-клеток, что проявляется в торможении первой фазы инсулинового ответа и развитии гипергликемии [5; 8].С целью изучения сравнительной характеристики ультраструктуры печени в норме и при сахарном диабете в эксперименте проведено настоящее исследование.
Материал и методы исследования
Материалом исследования явились половозрелые крысы-самцы линии «Вистар» массой 100-130 г в количестве 90 штук. Перед забором материала подопытных животных усыпляли с помощью внутрибрюшинного наркоза с использованием тиопентала натрия. Забирали небольшую часть ткани печени крыс, которую помещали сразу в большую каплю 2%-ного раствора четырехокиси осмия на 0,1 М фосфатном буфере с сахарозой. Далее вырезали полоски ткани печени размером 0,8 х 0,1 х 0,1 см и переносили их в другую каплю фиксирующего раствора, размещенного на кусочке зубоврачебного воска ледяной плиты. Из полосок вырезали блоки ткани печени кубической формы размером 1 мм3, которые фиксировали 2%-ным раствором четырехокиси осмия на 0,1 М фосфатном буфере (рН 7,36) с добавлением сахарозы в течение двух часов на ледяной бане, после чего их отмывали буферным раствором [1]. Водонерастворимые смолами и отмытые от остатков фиксаторов тканевые блоки проводили через спирты восходящей концентрации и абсолютный ацетон. Затем материал помещали в смесь эпоксидных смол эпон-аралдит путем проведения через растворы возрастающей концентрации, после чего их помещали в эпон-аралдит, находившийся в глицериновых капсулах [2; 3]. Полимеризацию материала проводили поэтапно при разных температурах от 36 до 60 °С в течение 24 часов. Ультратонкие срезы готовили на ультрамикротоме УМТП — 3М с помощью стеклянных ножей, изготовленных на приборе ССН — 1. Для исследования отбирали срезы серебристого или нежно-лимонного цвета. Срезы контрастировали сначала в 2℅-ном растворе уранилацетата [7], а затем – цитрата свинца [6]. Изучение и фотографирование материала проводили с помощью микроскопа УЕМВ — 100К .
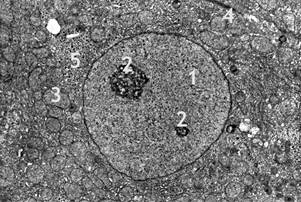
В норме у интактных крыс печеночные пластинки построены из гепатоцитов, объединенных с помощью плотных контактов, образующих желчные канальцы. При ультраструктурном исследовании в цитоплазме гепатоцитов хорошо выражены канальцы эндоплазматической сети, многочисленные лизосомы и пероксисомы, цистерны комплекса Гольджи, расположенные в различных отделах клеток. Митохондрии имеют сферическую или овальную форму от 0,8 до 2 мкм в диаметре, небольшую численность крист и электронноплотный матрикс с митохондриальными гранулами. В цитоплазме гепатоцитов находятся включения гликогена и липидов. Гранулы гликогена местами образуют агрегаты в виде розеток, тогда как липидные гранулы имеют вариабельнную электронную плотность и не окружены мембранами. Ядра, как правило, расположены в центре гепатоцитов и имеют овальную или сферическую форму с просветленным хроматином. Ядра содержат 1-2 ядрышка и имеют широкопетлистую ретикулярную структуру (рис. 1).
Рис. 1. Печень интактной крысы. Фрагмент гепатоцита. Увеличение x 5000.
1 – ядро; 2 – ядрышки; 3 – митохондрии; 4 – канальцы эндоплазматической сети; 5 – включения гликогена.
Эндотелиоциты отделяют пространства синусоидов от пиресинусоидальних пространств и имеют продолговатую форму, а их ядра располагаются в центре. Вокруг полюсов ядра находится компактная зона органелл с цистернами комплекса Гольджи, канальцами агранулярной и гранулярной эндоплазматической сети и многочисленными митохондриями. Наибольшей протяженностью характеризуется периферийная зона, в которой расположены немногочисленные органеллы. Она содержит плазмолемные везикулы, связанные с базальной и адлюменальной поверхностями плазмолемы. В периферийной части эндотелиоцитов расположены фенестры, не затянутые диафрагмами. В месте контактов эндотелиоциты содержат многочисленные отростки, благодаря которым образуются ситообразные зоны в стенке синусоидов. Базальная мембрана вокруг эндотелиальных клеток не образует сплошного слоя, ее фрагменты выявляются вокруг периферической зоны эндотелиоцитов. В просветах синусоидов и между эндотелиоцитами расположены звездчатые макрофагоциты. Они имеют многочисленные псевдоподии и складки мембраны с ядрами бобовидной формы. Вблизи вогнутой поверхности ядра находятся цистерны комплекса Гольджи и многочисленные лизосомы. В просветах синусоидов обнаруживаются печеночные клетки-убийцы. Они имеют сферическую форму, электронноплотные ядра и своими отростками фиксируются к плазмолемме эндотелиоцитов. Их цитоплазма содержит гранулы с электронноплотным центром, а также фагоцитарные пузырьки. При ультраструктурном исследовании портальных триад обнаруживаются междольковые артерии, вены, желчные протоки, а также лимфатические сосуды. Стенка междольковых артерий состоит из трех оболочек. Во внутренней оболочке находится сплошной пласт эндотелиальных клеток, расположенных на базальной мембране. В подэндотелиальном слое расположены малодифференцированные клетки, эластичные и коллагеновые волокна. В междольковых артериях хорошо выражена внутренняя эластическая мембрана. Средняя оболочка включает 1-2 слоя гладких миоцитов. Внешняя оболочка состоит из адвентициальних клеток. Вокруг артерий расположены фибробласты, коллагеновые и эластичные волокна. В просветах междольковых вен иногда оказываются моноциты и лимфоциты. В средней оболочке гладкие миоциты не образуют сплошного слоя, их внешняя оболочка состоит из рыхлой соединительной ткани, а в периваскулярном пространстве расположены фибробласты, коллагеновые и эластичные волокна, а также одиночные лимфоциты. Стенка междольковых желчных протоков состоит из кубических клеток с электронно-светлой цитоплазмой и ядрами. Вокруг желчных протоков находятся фибробласты, коллагеновые и эластичные волокна, а также единичные лимфоциты.
Через 8 недель развития экспериментального СД нами отмечено увеличение численности и размеров жировых включений в цитоплазме гепатоцитов и уменьшение включений гликогена (рис. 2).
Рис. 2. Печень крыс через 8 недель после введения стрептозотоцина. Сб. × 7000.
1 – отек эндотелиоцитов; 2 – сладж эритроцитов в просвете синусоида; 3 – гиперплазия коллагеновых волокон в перисинусоидальных пространствах.
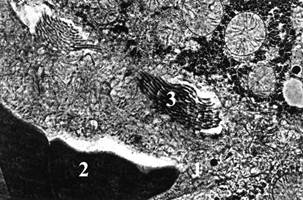
Возрастает число митохондрий и гетерогенность в структуре ядер. При этом встречаются сферические ядра со структурой хроматина и ядрышек, подобных интактным животным, но с увеличенной численностью гиперхромных ядер и конденсированным по краям хроматином. Перинуклеарные пространства вокруг таких ядер значительно расширены. Обнаруживаются гепатоциты с пикнотическими ядрами, которые имеют причудливую форму. Межклеточные пространства гепатоцитов видоизменены и расширены, в них выявляются коллагеновые фибриллы и фибробласты. Перисинусоидальные пространства расширены, заполнены коллагеновыми волокнами, среди которых обнаруживаются многочисленные фибробласты, звездчатые макрофагоциты и редко перисинусоидальные жиронакопительные клетки, в цитоплазме которых находятся гигантские удлиненные митохондрии червеобразной формы с многочисленными плотноупакованными кристами. Диаметры синусоидов сужены, часто встречается сладж эритроцитов, а также многочисленные звездчатые макрофагоциты и тромбоциты, которые контактируют с плазмолемой эндотелиоцитов. Эндотелиоциты в периферийной зоне утолщены. Их цитоплазма имеет неоднородную электронную плотность и содержит темные и светлые клетки, вакуоли, канальцы эндоплазматической сети, а также расширенные комплексы Гольджи и полиморфные митохондрии. Часто обнаруживаются просветленные митохондрии с деструктурированными кристами. Плазмолемальных везикул в таких клетках мало по сравнению с интактной группой животных. Ядра в эндотелиоцитах часто отечны, осмиофильные (рис. 3).
Рис. 3. Печень крыс через 8 недель после введения стрептозотоцина.
1 – сужение просветов синусоидов; 2 – утолщенные стенки синусоидов; 3 – базальная мембрана вокруг эндотелиоцитов.
Вокруг эндотелиоцитов обнаруживается базальная мембрана. В портальных трактах – выраженный склероз. Стенки артериол утолщены, эндотелиальная выстилка в них не сплошная. В средней оболочке наблюдаются процессы гипертрофии и гиперплазии гладких миоцитов. Стенка вен склерозирована и утолщена с наличием деструктивных фибробластов. Пространство желчных протоков расширено и заполнено остатками эпителиоцитов. Вокруг желчных протоков наблюдается гистиолимфоцитарная инфильтрация с отечными эндотелиоцитами и расширение диаметров лимфатических сосудов.
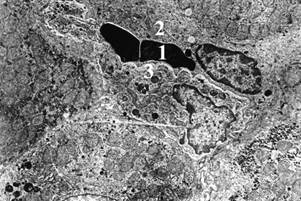
Через 10 недель эксперимента, наряду с вышеуказанными изменениями, отмечается увеличение числа деструктуризированых митохондрий и крупных жировых включений в гепатоцитах с уменьшением в них содержания гликогена (рис. 4).
Рис. 4. Печень крыс через 10 недель после введения стрептозотоцина. Сб. × 3000.
1 – деструкция митохондрий; 2 – выраженная жировая дистрофия цитоплазмы гепатоцитов.
Возрастает количество пикнотичных и формализованных ядер в гепатоцитах, расширяются их межклеточные и перисинусоидальные пространства и просветы в желчных капиллярах. Обнаруживаются разрастания коллагеновых волокон с гипертрофией и гиперплазией фибробластов. Возрастает численность снежных макрофагоцитов, суживаются синусоидальные капилляры и уменьшается численность перисинусоидальных жиронакопительных клеток. В них часто обнаруживается сладж эритроцитов и лейкоцитов. Эндотелиальные клетки в стенке синусоидных капилляров полиморфны. Их цитоплазма неоднородна с малым количеством органелл и деструктироваными митохондриями. Ядра часто выступают в просвет синусоидов, в них наблюдается маргинальная агрегация хроматина, ядрышки не определяются. Вокруг зоны органелл часто образуется базальная мембрана. В портальных трактах наблюдается склероз и гиперплазия фибробластов. При этом стенки междольковых артерий утолщены и склерозированы, в их просветах часто появляются пристеночные тромбы. Диаметры междольковых желчных протоков расширены, их стенки утолщены, лимфатические сосуды расширены.
Таким образом, на поздних этапах развития экспериментального СД происходят изменения в артериолах, характеризующиеся деструкцией эндотелиоцитов, гипертрофией и гиперплазией гладких миоцитов, сужением просвета и гиперплазией фибробластов в наружной оболочке артериол, а также гиперемией центральных и междольковых вен. В синусоидах, наряду с деструктивными изменениями в эндотелиоцитах, проходят процессы активации и увеличения численности макрофагоцитов и их миграция в перисинусоидальные пространства, что приводит к трансформации жиронакопительных клеток в фибробласты и разрастанию коллагеновых волокон. Расширение перисинусоидальных пространств приводит к утолщению барьера между кровью и гепатоцитами с последующим нарушением обмена веществ.
Рецензенты:
Матещук-Вацеба Л.Р., д.м.н., профессор кафедры нормальной анатомии Львовского национального медицинского университета им. Данила Галицкого, г. Львов.
Жилякова Е.Т., д.ф.н., профессор, зам. директора ООО «Асклепий», г. Белгород.
Источник
Масса печени у крыс
Содержание микроэлементов (МЭ) в здоровом организме, его органах и тканях поддерживается в определенных границах. Баланс МЭ обусловлен их важной ролью в процессах жизнедеятельности. Они участвуют в многочисленных процессах комплексообразования с природными лигандами, такими как нуклеиновые кислоты, углеводы, пептиды, белки, витамины, гормоны, и обеспечивают их биологические функции [6]. Нарушения баланса МЭ в организме играют значимую роль в этиологии и патогенезе многих заболеваний [2]. Показана важная роль МЭ в развитии сахарного диабета [15], особенно второго типа [9, 14], и нарушений толерантности к глюкозе [14]. Особый интерес к МЭ при сахарном диабете обусловлен применением МЭ для разработки новых методов лечения сахарного диабета [15]. Значимость МЭ в патогенезе сахарного диабета и его осложнений обусловлена антиоксидантными свойствами, которые МЭ проявляют в связанном с ферментами системы антиоксидантной защиты виде [8, 13, 15]. Такая взаимосвязь антиоксидантного и микроэлементого статусов важна для понимания роли МЭ в патогенезе различных заболеваний [4], поскольку по современным представлениям именно окислительный стресс играет ключевую роль в развитии патологических процессов в организме [3].
Нарушения баланса МЭ при сахарном диабете проявляются в разнонаправленных изменениях содержания отдельных МЭ в крови и тканях [10, 14]. Это позволяет предположить связь изменений содержания МЭ либо с тяжестью заболевания, либо с действием каких-либо дополнительных факторов. В качестве таких модифицирующих микроэлементный баланс факторов при диабете могут выступать сочетанные патологические процессы, например воспаление. Хорошо известна высокая подверженность больных сахарным диабетом инфекционным и неинфекционным воспалительным заболеваниям.
Цель исследования: изучить содержание микроэлементов — меди, цинка, марганца, молибдена, в тканях печени и легкого крыс с аллоксановым диабетом после индукции воспаления внутривенным введением микрочастиц SiO2.
Материал и методы исследования
Работу проводили на половозрелых крысах-самцах породы Вистар. Животных содержали в одиночных клетках на стандартных кормах и со свободным доступом к воде. Во время эксперимента крыс разделили на 4 группы — контрольную и три подопытные. В контрольной группе были интактные животные. У крыс 1-й подопытной группы вызвали аллоксановый диабет путем однократного внутрибрюшинного введения раствора аллоксана, разведенного в 0,85 % водном растворе NaCl, в дозе 17 мг/100 г массы тела. Крысам 2-й подопытной группы однократно в хвостовую вену ввели суспензию микрочастиц диоксида кремния (SiO2) марки «S-563» (Sigma) с размером 1-5 мкм в 0,85 % водном растворе NaCl в дозе 10 мг/100 г массы тела, моделируя тем самым гранулематозное воспаление [7]. Крысам 3-й подопытной группы суспензию микрочастиц SiO2 ввели через 8 суток после введения аллоксана на фоне развившегося заболевания. Животных 1-й группы вывели из эксперимента через 9 суток после введения аллоксана, животных 2-й и 3-й групп — через 1 и 4 суток после введения микрочастиц SiO2. На всех сроках наблюдения в группах было по 5 животных. Формирование аллоксанового диабета у крыс подтверждали измерением в сыворотке крови содержания глюкозы ферментативным методом с использованием наборов «GLU» фирмы «BioCon». Ткань печени и легкого (по 1 г) забирали в пластиковые чашки Петри, высушивали до постоянного веса в термостате при 40 °С и хранили в пластиковых контейнерах. Содержание кремния (Si), цинка (Zn), меди (Cu), марганца (Mn) и молибдена (Mo) в высушенных образцах определяли методом атомно-эмиссионной спектрометрии с возбуждением спектров в двухструйной дуговой плазме высокой мощности. Метод не требует предварительного растворения образца, что минимизирует потери элементов и риск загрязнения пробы. Результаты выражали в мкг МЭ на 1 г сухого веса ткани.
Статистическую обработку результатов проводили методом дисперсионного анализа с использованием критерия Краскела-Уоллиса для множественных и непараметрического критерия Манна-Уитни для парных сравнений. Вероятность справедливости нулевой гипотезы принимали при 5 % уровне значимости (р * — р
Источник