- IX Международная студенческая научная конференция Студенческий научный форум — 2017
- КЛИНИЧЕСКИЕ ПРИЗНАКИ, ЛЕЧЕНИЕ И ПРОФИЛАКТИКА МИКОПЛАЗМОЗА У ДЕКОРАТИВНЫХ КРЫС
- Гистологическая оценка патологических изменений суставов при различных способах индукции хронического артрита у крыс
- Резюме
- Введение
- Материал и методы
IX Международная студенческая научная конференция Студенческий научный форум — 2017
КЛИНИЧЕСКИЕ ПРИЗНАКИ, ЛЕЧЕНИЕ И ПРОФИЛАКТИКА МИКОПЛАЗМОЗА У ДЕКОРАТИВНЫХ КРЫС
Микоплазмоз — очень распространенное инфекционное заболевание. Его причиной является действие бактерии Mycoplasma pulmonis. Микоплазмы полиморфны, не имеют клеточной стенки, паразитируют внутри здоровых клеток организма. Поэтому полностью избавиться от возбудителя практически невозможно, он присутствует в организме 95% крыс, передается аэрогенно, через предметы ухода и от матери к потомству.
Вероятность заболевания зависит от состояния иммунитета зверька. Микоплазмоз долгое время может протекать бессимптомно, первые признаки появляются обычно у крыс старше года. Главными факторами развития данного заболевания являются стресс, переохлаждение и несбалансированное питание. В течении микоплазменной инфекции выделяют 3 стадии.
Латентная, без клинических признаков, зверек выглядит полностью здоровым. Выявить заболевание можно только с помощью лабораторных исследований ИФА и ПЦР. На данном этапе лечение не требуется. В качестве профилактики можно давать крысе витамины, пробиотики. Необходим тщательный уход за содержанием животного. Клетка должна быть чистой, с сухой подстилкой, без сквозняков. Если соблюдать правила кормления и содержания, то вероятность того, что заболевание не перейдет в следующую стадию, увеличивается до 80%.
Первые клинические признаки. Для данной стадии характерны поражение кожи, такие как зуд, расчёсы, облысение, изменение структуры волос. Развивается ринит с кашлем, крыса начинает издавать не характерные для нее звуки – «курлыканье», «мурлыканье». Периодически возникают приступы затрудненного дыхания с шумом, хрипом. Из носа и глаз наблюдается выделение порфирина (жидкость красного или красно-бурого цвета). Течение заболевания усугубляется вдыханием зверьком табачного дыма, аммиачных испарений от грязной подстилки, сильно пахнущих химических средств. Стандартным лечением на этой стадии является применение антибиотиков и фитотерапия. Используют один из следующих препаратов:
— Азитромицин (сумамед) в виде сиропа или суспензии в дозе 10мг/кг за 1 час до кормления 2 раза в день в течение 7 дней, затем 1 раз в день 10 дней.
— Левофлоксацин 250 мг, применяется только для взрослых крыс, по 2-3 мг 1 раз в день в течение 2-3 недель. Таблетку 250 мг размельчают, разводят в 10 мл теплой воды, выпаивают крысе по 0,1 мл.
— Доксициклин 100 мг, доза 5 мг/кг, дают больному зверьку 2 раза в день в течение 2-4 недель в зависимости от запущенности заболевания. Капсулу 100 мг нужно растворить в 10 мл воды и давать по 0,2 мл/кг. Исключить из рациона молоко и молочные продукты во время лечения доксициклином.
— Байтрил 2,5% раствор по 0,1 мг/кг 2 раза в день подкожно или внутримышечно. Используется для крыс старше 3 месяцев.
— Тилозин по 10 мг/кг 2 раза в день подкожно или внутримышечно, возможно выпаивание препарата.
Такие препараты, как гентамицин, пенициллин, тетрациклин, канамицин очень токсичны для крыс, их применение нежелательно.
Если не начать лечение во второй стадии заболевания, то развивается микоплазменная пневмония, в результате вторичной инфекции в легких появляются абсцессы, поражаются печень и почки, наблюдаются симптомы сердечной недостаточности. Крыса тяжело дышит — «дыхание боками», горбится, поднимает голову вверх, теряет аппетит, худеет, становится вялой, сонливой. Зверек пытается занять более удобное положение для облегчения дыхания, лежит, свесив голову вниз, пытается расположиться ближе к притоку свежего воздуха. Может наблюдаться паническое поведение из-за неспособности животного получить достаточное количество кислорода. На поздних стадиях заболевания появляется цианоз конечностей. Прогноз неблагоприятный, помочь может только интенсивное лечение. Применяют следующий комплекс препаратов:
— Рибоксин внутримышечно по 0,3 мл 2 раза в день для купирования сердечной недостаточности;
— Дексаметазол внутримышечно по 0,1 мл/кг 1-2 раза в день в случае выраженной дыхательной недостаточности;
— Сочетание антибиотиков, так как применение одного препарата уже не даст результатов. Используются комбинации азитромицин + левофлоксацин, хлорамфеникол + тилозин. Хлорамфеникол применяют внутримышечно, подкожно, перорально в дозе 20-30 мг/кг 2 раза в день;
— Фуросемид 0,1 мг/кг внутримышечно 5-7 дней подряд для снятия отеков;
— Эуфиллин по одной капле для облегчения дыхания до улучшения состояния.
Кожный зуд, отит, ринит проходят после приема антибиотиков, но для облегчения состояния можно смазывать расчесы противозудными мазями, такими как фенистил. Ушные раковины прочищают чистыми ватными палочками. После курса антибиотиков нужно провести восстанавливающую терапию, включающую пробиотики, такие как лактобифид и лактобифидол. Сильным средством, стимулирующим иммунитет, является эхинацея. Для крыс подходит ее сухая трава и гомеопатические гранулы. 1 чайную ложку травы заливают 100 мл кипятка, настаивают 30 минут. Охлажденный отвар наливают в поилку вместо воды и оставляют на 2-3 часа. Курс приема 5-7 дней.
Таким образом, несмотря на то, что микоплазмоз распространен среди крыс, он поддается лечению, болезнь не запущена. Необходимо оградить крысу от провоцирующих факторов. У животных с нормальным иммунитетом микоплазменная инфекция не является большой проблемой.
Рахманов А.И. «99 советов. Декоративные крысы», 2001
Э. Кибл «Грызуны и хорьки. Болезни и лечение», 2013
Дж. Боуден «Дексаметазон и окситетрациклин для усиления реверсии нейрогенного воспаления в дыхательных путях крыс с инфекцией микоплазмы», 1994
James W. Carpenter «Exotic Animal Formulary», 1996
Источник
Гистологическая оценка патологических изменений суставов при различных способах индукции хронического артрита у крыс
А.А. Мужикян(1), кандидат ветеринарных наук, руководитель лаборатории гистологии и патоморфологии, Е.В. Шекунова(1,2), кандидат биологических наук, руководитель группы экспериментальной фармакологии, В.А. Кашкин(1,2), кандидат медицинских наук, руководитель исследований, старший научный сотрудник, М.Н. Макарова1, доктор медицинских наук, заместитель директора, В.Г. Макаров(1), доктор медицинских наук, директор 1 -ЗАО «Институт экспериментальной фармакологии», 188663, Россия, Ленинградская обл., Всеволожский р-н, г.п. Кузьмоловский, ул. Заводская, д. 3, корп. 245; 2 — Институт фармакологии им. А.В. Вальдмана, Первый Санкт-Петебургский государственный медицинский университет им. И.П. Павлова, 197022, Санкт-Петербург, ул. Льва Толстого, д. 6-8 e-mail: muzhikyan.aa@doclinika.ru
Резюме
Цель данного исследования – апробация известных гистологических критериев оценки изменений в суставах и сравнительный анализ 2 экспериментальных моделей хронического артрита – артрита, индуцированного введением полного адъюванта Фрейнда, и артрита, вызванного введением каррагинина. Клинические и гистопатоморфологические признаки оценивались не только качественно, но и категориальной системе. Показано, что введение полного адьюванта Фрейнда моделирует состояние ревматоидного артрита. Напротив, введение каррагинина способствует развитию хронического воспалительного артрита, лишенного аутоиммунологического компонента. Полученные результаты могут служить основой для выбора определенного методического подхода для фармакологической оценки эффективности лекарственных препаратов с антиревматоидным, противовоспалительным и (или) иммуномодулирующими свойствами давления. Приводится информация об изменениях основных характеристик в зависимости от пола и возраста лабораторных животных. Каждая из рассмотренных линий грызунов имеет специфические свойства, характерные для сахарного диабета и метаболического синдрома, что позволяет всесторонне изучать механизмы развития патологий, а также потенциальных лекарственных препаратов для терапии данных заболеваний.
Введение
Ревматоидный артрит (РА) – хроническое системное заболевание соединительной ткани аутоиммунной природы, при котором поражаются суставы. РА страдают около 1% взрослого населения планеты [1] и около 1 млн населения Российской Федерации [2]. Заболевание распространено во всем мире, частота встречаемости увеличивается с возрастом, причем женщины болеют в 3 раза чаще, чем мужчины. Хотя причины возникновения РА окончательно неясны, хорошо изучены механизмы воспалительного процесса, который приводит к постепенному разрушению суставов [3]. Воспаление приводит к прогрессирующей деструкции хрящевой ткани суставов, синовиальной гиперплазии, синовиту, эрозии костной ткани, повышению уровня медиаторов воспаления.
В экспериментальных исследованиях хронический артрит моделируется введением различных агентов, в том числе введением полного адъюванта Фрейнда, лямбда-каррагинина, коллагена, формалина. Данные модели широко используются для изучения специфической противовоспалительной и противоревматоидной активности фармакологических веществ. Однако клиническая картина, развивающаяся при введении различных индуцирующих агентов, имеет свои особенности. Так, клинические признаки артрита появляются приблизительно через 10 дней после введения адъюванта и через 21 день после введения каррагинина [4]. Адъювант-индуцированный артрит (АИА) – это Т-лимфоцитарнозависимый артрит, который во многом схож с РА, включая развитие отека околосуставных тканей, деградацию хряща, потерю функциональной активности сустава, лимфоцитарную инфильтрацию внутрисуставной полости. При АИА наблюдается резорбция костной ткани, однако поражения хряща выражены в меньшей степени, чем при экспериментальном артрите, вызванном введением коллагена [5]. Напротив, каррагининовая модель артрита не сопровождается подобной активацией иммунного ответа, так как макрофаги не способны к переработке молекулы каррагинина, в результате чего происходит его накопление в лизосомах с развитием воспалительной реакции и последующей гибелью клетки [6]. Таким образом, активированные Т-клетки
не участвуют в запуске иммунного ответа при данной модели артрита.
В данном исследовании был проведен сравнительный анализ 2 экспериментальных моделей хронического артрита – артрита, индуцированного введением полного адъюванта Фрейнда, и артрита, вызванного введением каррагинина. Были детально изучены гистопатоморфологические изменения, которые наблюдались на разных этапах развития патологии. Полученные результаты могут служить основой для выбора определенного методического подхода для фармакологической оценки эффективности лекарственных препаратов с антиревматоидным, противовоспалительным и (или) иммуномодулирующими свойствами.
Материал и методы
Эксперименты выполнены на самках крыс линии Вистар массой 200–250 г (питомник «Рапполово», Россия). Животных содержали в стандартных условиях, согласно Директиве 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях и в соответствии с Санитарно-эпидемиологическими требованиями к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев) (СП 2.2.1.3218-17; утв. постановлением Главного государственного санитарного врача РФ № 41 от 29 августа 2014 г.).
В период адаптации крысы группами по 4 особей были размещены в прозрачных клетках из поликарбоната с площадью пола 1419 см 2 (минимально допустимая площадь на 1 животное – 250 см 2 ). В качестве подстила использовали древесные гранулы (ООО «Биосфера», Санкт-Петербург, Россия).
Корм для лабораторных животных «ЛБК–120», изготовленный в соответствии с ГОСТ Р 50258-92 «Комбикорма полнорационные для лабораторных животных», давали ad libitum в кормовое углубление стальной решетчатой крышки клетки.
Животные получали воду, очищенную и нормированную по органолептическим свойствам, по показателям рН, сухого остатка, восстанавливающих веществ, диоксида углерода, нитратов и нитритов, аммиака, хлоридов, сульфатов, кальция и тяжелых металлов на основании СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества». Воду в стандартных поилках со стальными крышками-носиками давали ad libitum.
Животных содержали в контролируемых условиях окружающей среды (при температуре 19–25°C и относительной влажности воздуха 30–70%, NH3≤10 мг/м 3 , CO2≤0,15 об.%). Световой режим составил 12 ч света и 12 ч темноты. Был установлен режим воздухообмена, обеспечивающий смену около 15 объемов помещения в час.
За неделю до начала эксперимента животные были рассажены в клетки индивидуального содержания.
Экспериментальные процедуры были одобрено комитетом по биоэтике НПО «Дом фармации» (БЭК №1.36/16) и выполнены в соответствии с рекомендациями Директивы 2010/63/EU Европейского парламента, Совета Европейского Союза от 22 сентября 2010 г. по охране животных и политикой Национальных институтов здоровья США «Принципы лабораторного ухода за животными». Все данные были собраны и проанализированы 2 независимыми наблюдателями, которые не знали о групповой принадлежности животных. Это исследование соответствовало принципам 3R (reduction, refinement and replacement). Все усилия были направлены на минимизацию страданий животных и сокращение их числа.
Индукция артрита и дизайн эксперимента. Адъювант-индуцированный артрит АИА. Для индукции артрита крысам в плантарную поверхность задней лапы вводили полный адъювант Фрейнда (complete Freund adjuvant (CFA)) производства Sigma-Aldrich в объеме 100 мкл [7, 8].
Каррагенин-индуцированный артрит (КИА). При моделировании каррагенин-индуцированного артрита в плантарную часть задней лапы крыс самок вводили 100 мкл 3% λ-каррагенина [9].
На 29-й день эксперимента животные были эвтаназированы в СО2-камере.
Гистологическое исследование. Исследуемые отделы конечностей ампутировали на уровне нижней трети голени рассечением мягких тканей, большой и малой берцовой костей, без нарушения целостности суставов, с фиксацией материала для гистологического исследования.
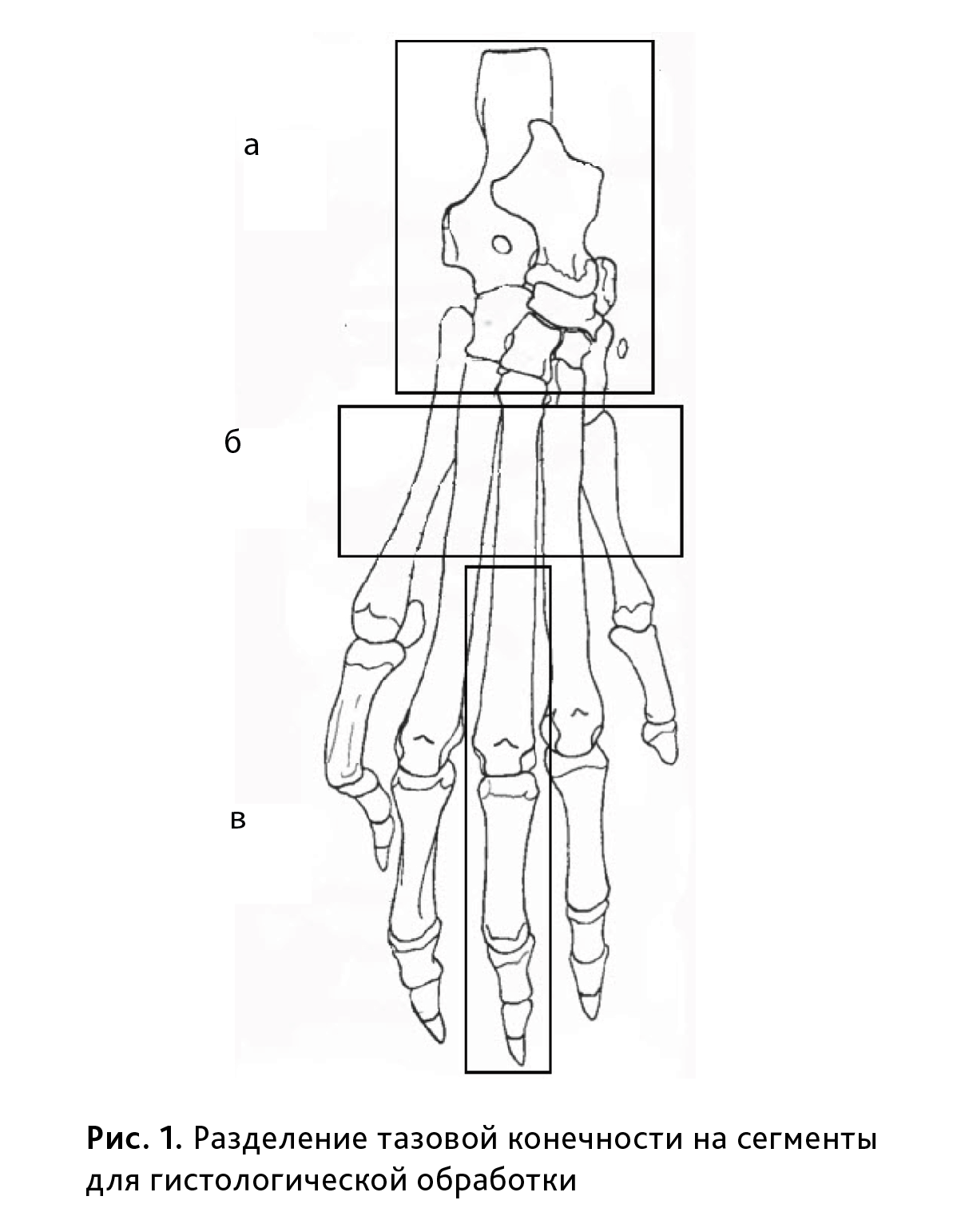
Гистологическому исследованию были подвергнуты пораженные суставы крыс, в том числе заплюсневый сустав, образованный блоком костей голени, костями заплюсны и проксимальным концом плюсневых костей, включающий в себя art. tarsocruralis, aa. intertarsae (представленный a. talocalcaneonavicularis, a. talocalcanea, a. calcaneocuboidea, a. cuneonavicularis), art. tarsometatarsea, а также плюснофаланговые, венечные и дистальные межфаланговые суставы пальцев стопы. Для этого конечности крыс фиксировали в 10% растворе нейтрального формалина, затем декальцинировали в электролитном растворе на основе муравьиной и соляной кислот в течение 14 дней, после чего делили на сегменты (рис. 1) и заливали в парафин. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином.
Анализ гистологических препаратов выполняли с помощью светооптического микроскопа Carl Zeiss Axio Scope A1 (Германия) при увеличении 50, 100, 200 и 400. Микрофотографирование проводили цифровой фотокамерой AxioCam ICc 1 и с помощью программного обеспечения AxioVision Rel. 4.8 (Германия).
Структуры заплюсневого сустава и мягких тканей изучали на сагиттальных и плантарных срезах конечности (см. рис.1, а, б); для изучения межфаланговых суставов дистальную часть конечности отделяли поперечным разрезом плюсневых костей, а суставы, образованные плюсневыми костями, проксимальными, средними и дистальными фалангами изучали на сагиттальных срезах (см. рис. 1, в). Таким образом, было исследовано не менее 10 суставов каждого животного, попавших на срез. Критериями гистологической оценки служили изменения околосуставного аппарата (фиброзной и синовиальной капсулы), наличие воспалительного инфильтрата, состояние суставного хряща и костной ткани. В баллах от 0 (норма) – до 5 (максимальная выраженность патологии) оценивали 6 параметров.
Степень поражения суставов оценивали по модифицированной шкале Hegen (2003) [10], при этом анализировали следующие показатели:
- выраженность общего воспаления сустава (наличие инфильтрата, эдемы, выпота);
- степень сужения суставной полости;
- изменения костной ткани (остеолизис);
- изменения синовиальной оболочки (гиперплазия);
- выраженность паннуса (наличие в субинтимальном слое суставной капсулы грануляционной ткани с высоким содержанием фибробластов, лимфоцитов и макрофагов);
- степень дегенерации хряща.
При максимальной выраженности патологического процесса комплексная оценка для 1 животного составляла 30 баллов.
Более детально оценивали характер и выраженность изменений хрящевой ткани сустава по модифицированной шкале Mankin в баллах от 0 (норма) до 3 [11, 12]. Анализировали следующие показатели:
структура поверхности (1 балл – неровности, эрозии, 2 балла – трещины, 3 балла – расслоение);
клеточный состав (1 балл – незначительное снижение количества хондроцитов, 2 балла – значительное снижение количества хондроцитов, 3 балла – нет клеток);
окрашивание (1 балл – незначительное снижение окрашивания, 2 балла — значительное снижение окрашивания, 3 балла – нет окрашивания);
пролиферация клеток (1 балл – изогенные группы хондроцитов; по 2 клетки в группе; 2 балла – изогенные группы хондроцитов; по 2 и 3 клетки в группе); 3 балла – очаги пролиферации (более 3 клеток в группе).
При максимальной выраженности патологического процесса комплексная оценка для 1 животного составляла 12 баллов.
Статистическая обработка. Для анализа данных использовали тест Манна–Уитни, критерий Уилкокосона. Различия были определены при уровне значимости р
Источник