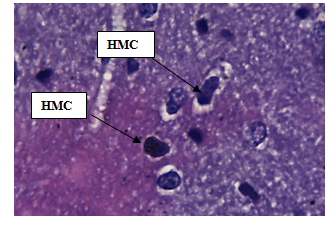
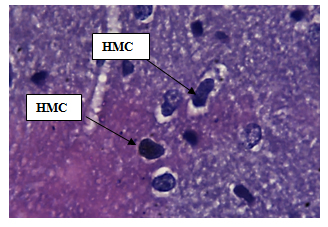
Нервные клетки передних рогов мозга крысы
Целью исследования явилось изучение клеточного состава и морфометрических показателей слоев переднетеменной зоны коры головного мозга половозрелых крыс-самцов.
Материалы и методы исследования
Исследования проводились на 20 белых беспородных половозрелых крысах-самцахмассой 200–250 г, на 8–10-й неделе постнатального онтогенеза. Животные забивались путем декапитации под наркозом смеси эфира с хлороформом (1:1) с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации, и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных.
Материалом для исследования служили участки коры головного мозга крыс, выделяемые согласно цитоархитектоническим картам [1;4].Фиксацию мозга осуществляли 10%-нымраствором формалина, приготовленном на 0,2 М фосфатном буфере, и смесью Карнуа. При отсутствии макроскопическивидимых повреждений органа делали продольный срез на уровне продолговатого мозга. Парафиновые срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином для обзорных целей, а для изучения цитоархитектоники – метиленовым синим по Нисслю.
Исследования препаратов проводились с помощью цифрового микроскопа MT 4000 SeriesBiologicalMicroscope с программным обеспечением для анализа изображений BioVisionVersion 4.0. Фотосъемку препаратов производили с помощью встроенной цифровой камеры при увеличении 10×10, 40×10 и 100×10.Разрешение полученных изображений1280×1024 пикселей.
Результаты исследования и их обсуждение
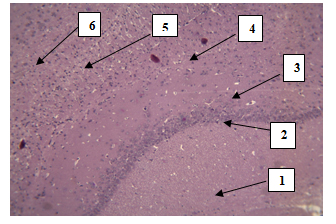
При гистологическом исследованиинеокортексабелой крысы обнаружено 6 слоев нервных клеток, снаружи внутрь располагающиеся в следующем порядке:1)молекулярный слой; 2) наружный зернистый слой; 3) наружный пирамидный слой; 4) внутренний зернистый слой; 5) внутренний пирамидный слой; 6) полиморфный слой (рис. 1).
Исследования показали, что молекулярный слой содержит редкие нейроны слегка вытянутой или овальной формы диаметром 4,19±0,51 мкм. Средняя площадь клетки составляет 21,07±1,19 мкм. Нейроны содержат мелкие ядра площадью 8,24±0,53 мкм2 и диаметром 1,36±0,23 мкм. Цитоплазма клетки имеет мелкозернистую структуру. Основной объем молекулярного слоя составляют отростки – аксоны и дендриты. Толщина слоя составляет 88,44±0,94 мкм (рис. 2, табл.1).
Рис. 1.Кора больших полушарий головного мозга крыс.Окраска гематоксилином и эозином. Стрелками обозначены слои нервных клеток (снизу вверх: 1–молекулярный; 2-наружный зернистый; 3-наружный пирамидный; 4-внутренний зернистый; 5-внутренний пирамидный; 6-полиморфный). Ув. 10×10
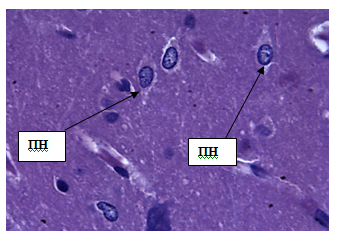
Рис. 2. Молекулярный слой коры больших полушарий. Стрелкой обозначены нейроны молекулярного слоя коры больших полушарий (НМС). Окраска гематоксилином и эозином. Ув. 100×10
Наружный зернистый слой образован крупными нейронами диаметром 10,11±0,43 мкм, имеющими округлую и пирамидальную форму. Средняя площадь клеток 74,58±1,92 мкм2. Нейроны содержат ядра слегка вытянутой или овальной формы площадью 22,47±0,91 мкм2и диаметром 4,69±0,44 мкм. Цитоплазма клетки имеет крупнозернистую структуру. Клетки расположены плотно, образуя четко отделяющийся слой,толщиной 62,81±0,46 мкм (рис. 3, табл.1).
Наружный пирамидный слой представлен немногочисленными пирамидными нейронами конической формы площадью 27,14±0,67 мкм2, диаметром 6,87±0,48 мкм. Нейроны содержат мелкие ядра, имеющие округлую форму. Средняя площадь ядер слоя составляет 8,82±0,47 мкм2, диаметр 4,14±0,39 мкм.Цитоплазма клеток имеет гладкую, незернистую структуру. Толщина слоя 119,18±1,74 мкм (рис. 4, табл.1).
Рис. 3. Наружный зернистыйслой коры больших полушарий. Стрелкой обозначены нейроны наружного зернистого слоя (НЗК). Окраска гематоксилином и эозином. Ув. 100×10
Рис. 4. Наружный пирамидный слой коры больших полушарий. Стрелками обозначены пирамидные нейроны (ПН). Окраска гематоксилином и эозином. Ув. 100×10
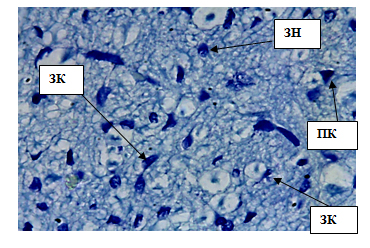
Внутренний зернистый слой содержит мелкие звездчатые клетки площадью 31,60±1,14 мкм2 и диаметром 5,93±0,43 мкм. Ядра перикарионов округлой формы, имеют четко выраженную структуру. Средняя площадь ядер 8,82±0,47 мкм2, диаметр 2,18±0,32 мкм. Цитоплазма в клетке распределена равномерно, без крупных белковых включений. Толщина слоя 664,38±0,66 мкм (рис. 5, табл.1).
Внутренний пирамидный слой представлен крупными нейронами (клетки Беца, клетки Мейнерта) и небольшим количеством звездчатых клеток. Клетки Беца самые крупные нейроны коры площадью 149,31±1,18 мкм2 и диаметром 13,66±0,89 мкм, которые дают начало миелиновым волокнам пирамидного тракта.
Рис. 5. Внутренний зернистый слой коры больших полушарий. Стрелкой обозначены звездчатые клетки (ЗК), пирамидные клетки (ПК), зернистые нейроны(ЗН). Окраска метиленовым синим по Нисслю. Ув. 100×10
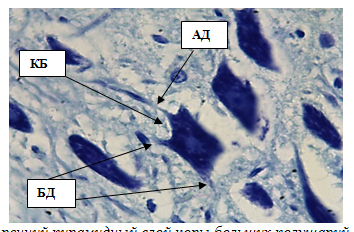
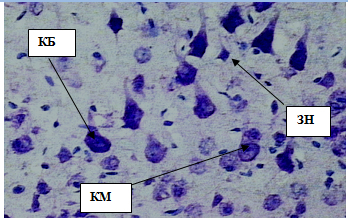
Цитоплазма не содержит включений, ядра крупные, площадью 28,83±0,61 мкм2, диаметром 6,34±0,57 мкм. Клетки Бецаимеют длинный апикальный дендрит, выходящий из вершины пирамиды в вышележащие слои, и другие дендриты, отходящие сбоку и от основанияперикариона. От основания пирамиды отходит аксон, уходящий в белоевещество(рис. 6, табл.1). Клетки Мейнерта – достаточно крупные нейроны, локализованные на протяжении всего V слоя коры полушарий.Средняя площадь клеток 86,13±0,96 мкм2, диаметр 9,23±0,40 мкм. Клетки имеют пирамидную форму, однако по сравнению с клетками Беца лишены крупных апикальных и боковых дендритов, ихядра относительно крупные, округлые, площадью 16,59±0,67 мкм2. Средняя толщина внутреннего пирамидного слоя составляет 285,61±0,99 мкм. Перикарионы звездчатых нейронов имеют округлую, полигональную или треугольную форму, 9–14 мкм в диаметре (рис. 7).
Полиморфный слой образован множеством нейронов различной величины и формы, а также некоторым количеством пирамидных и зернистых нейронов (рис.8). Клетки располагаются цепочками. Пирамидные нейроны имеют слегка вытянутую форму с заметными удлинениями, площадь которых 71,97±1,55 мкм2.Ядра небольшие с ровной структурой, площадью 11,83±0,45 мкм2. Зернистые нейроны имеют округло-угловатую форму размером от 74–77 мкм. Цитоплазма с крупными белковыми включениями, придающими зернистость внутреннему содержимому клетки. Ядра клеток вытянутые, площадью 16,08±0,92 мкм2, диаметром 5,15±0,36 мкм.
Рис. 6. Внутренний пирамидный слой коры больших полушарий. Стрелками обозначены:клетки Беца (КБ), апикальный дендрит (АД), боковые дендриты (БД). Окраска метиленовым синим по Нисслю.Ув. 100×10
Рис. 7. Внутренний пирамидный слой коры больших полушарий. Стрелками обозначены:клетки Беца (КБ), клетки Мейнерта (КМ), звездчатые нейроны (ЗН). Окраска метиленовым синим по Нисслю. Ув. 40×10
Морфометрические показатели нейронов коры головного мозга
Источник
В мозге крыс нашли эмоциональные зеркальные нейроны
Christian Keysers et al. / Current Biology, 2019
Нидерландские ученые обнаружили в мозге крыс эмоциональные зеркальные нейроны. С помощью эксперимента, в ходе которого крысе причиняли боль с помощью лазера, а также показывали, как другую крысу бьют током, исследователи выделили в передней поясной коре (отделе, который в том числе отвечает за эмпатию) их головного мозга популяцию нейронов, которые активны как при ощущении боли, так и при наблюдении за тем, как ее испытывает кто-то другой. Статья опубликована в журнале Current Biology.
За эмпатию в головном мозге отвечает, помимо прочих участков, передняя поясная кора — эволюционно новый отдел, хорошо развитый у высших приматов и некоторых млекопитающих. Работы, проведенные с участием людей, показывают, что этот отдел активируется тогда, когда человек испытывает боль сам, и тогда, когда он наблюдает за тем, как больно кому-то другому: это позволяет вынести предположение о том, что в передней поясной коре есть особый тип нейронов — зеркальные нейроны. Тем не менее, это до сих пор не было точно доказано, во многом из-за того, что передняя поясная кора также участвует в процессе обработки других эмоциональных стимулов.
Прояснить этот вопрос решили ученые под руководством Кристиана Кейсерса (Christian Keysers) из Нидерландского института нейробиологии. Они провели эксперимент на крысах, которых разделили на пары. В мозг одной крысы из пары вживили электроды для мониторинга активности передней поясной коры: эта крыса была отделена от своего партнера прозрачной перегородкой. Крыса за перегородкой получала удар током, который сопровождался определенным звуком. Ученые записывали реакцию крысы с подключенными электродами в момент удара другой крысы током, а также в отдельном условии — когда ей причиняли боль с помощью лазера. Еще в одном условии ученые изучили, как мозг крысы реагирует на звук, которым сопровождался удар другой крысы током: это необходимо было для того, чтобы оценить активность мозга в ответ на стимул, который вызывает у животного страх. И лазер, и удар током подавались с разной силой. В качестве основного показателя поведенческой реакции ученые наблюдали за тем, как крысы «застывают» при воздействии различных стимулов: как болевого, так и наблюдения за крысами, которым причиняют боль.
Ученые обнаружили, что нейроны в изученной области, активные во время того, как крыса испытывала боль, и во время того, как другая крыса за ней наблюдала, пересекаются. Причем это пересечение было заметнее, чем с нейронами, которые активны во время того, как крысе включали звук, который сопровождал удар током: это помогло ученым отвергнуть предположение о том, что специфичные как для обработки болевого стимула, так и наблюдения за тем, как боль испытывает кто-то другой, также активны и под воздействием другого отрицательного эмоционального стимула — страха. Также ученым не удалось добиться отмены реакции на устрашающий стимул при инъекции мусцимола — препарата-агониста ГАМКА-рецептора (одного из основных «тормозных» рецепторов головного мозга — ГАМК-рецепторов), введение которого в область передней поясной коры снижало реакцию крыс на боль, которую испытывают другие крысы.
Активные нейроны в передней поясной коре при получении болевого стимула, наблюдении за ним, в контрольном условии и при устрашающем стимуле
Christian Keysers et al. / Current Biology, 2019
Источник
Нервные клетки передних рогов мозга крысы
НИИ неврологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
ГБОУ ВПО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; ФГБУ «Северо-Западный федеральный медицинский исследовательский центр» Минздрава России; СПБ ГБУЗ «Городская больница №26», Санкт-Петербург, Россия
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
Санкт-Петербургский государственный медицинский университет им. И.П. Павлова; Городская больница №31 им. Я.М. Свердлова, Санкт-Петербург
Санкт-Петербургский государственный медицинский институт им. акад. И.П. Павлова
Применение нейроцитопротекторов в условиях экспериментальной ишемии спинного мозга у крыс
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(6): 42-46
Пономарев Г. В., Шмонин А. А., Шумеева А. Г., Алиев К. Т., Власов Т. Д., Скоромец А. А. Применение нейроцитопротекторов в условиях экспериментальной ишемии спинного мозга у крыс. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(6):42-46.
Ponomarev G V, Shmonin A A, Shumeeva A G, Aliev K T, Vlasov T D, Skoromets A A. The administration of neurocytoprotectors in a rat model of experimental spinal cord ischemia. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2017;117(6):42-46.
https://doi.org/10.17116/jnevro20171176142-46
НИИ неврологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия


Цель исследования. Изучить влияние лекарственного препарата кортексин на функциональное восстановление и морфологическую картину спинного мозга крыс с ишемией спинного мозга. Материал и методы. Ишемия спинного мозга достигалась перевязкой инфраренального отдела брюшной аорты у 16 крыс, разделенных на две группы. Животным опытной группы, в отличие от контрольной, предварительно вводили кортексин внутрибрюшинно в дозе 0,15 мг/кг за 30 мин до процедуры. Проводилась оценка неврологического статуса по шкале Тарлова, морфологическая оценка путем анализа гистологических срезов пояснично-крестцовых сегментов спинного мозга, окрашенных тионином по методике Ниссля, и статистическая обработка полученных данных. Результаты и заключение. Выявлен статистически значимый эффект кортексина, который клинически выражался в уменьшении неврологического дефицита (p=0,0095), морфологически — в увеличении числа нормохромных нейронов (р=0,01) и уменьшении сморщенных нейронов (р=0,0001) и клеток-теней (р=0,0003). Полученные данные позволяют предполагать потенциальный миелопротективный эффект кортексина и рассматривать этот лекарственный препарат в контексте лечения сосудистой миелопатии.
НИИ неврологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
ГБОУ ВПО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; ФГБУ «Северо-Западный федеральный медицинский исследовательский центр» Минздрава России; СПБ ГБУЗ «Городская больница №26», Санкт-Петербург, Россия
ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург, Россия
Санкт-Петербургский государственный медицинский университет им. И.П. Павлова; Городская больница №31 им. Я.М. Свердлова, Санкт-Петербург
Санкт-Петербургский государственный медицинский институт им. акад. И.П. Павлова
За последнее десятилетие достигнут существенный прогресс в понимании молекулярных основ и патофизиологических процессов, происходящих в условиях экспериментальной ишемии спинного мозга (ИСМ) [1]. Однако, несмотря на успехи фундаментальной медицины, сосудистая миелопатия остается тяжелым заболеванием с неблагоприятным реабилитационным прогнозом [2].
Сравнительно небольшая распространенность заболевания, составляющая 1,2% от общего количества острых нарушений мозгового кровообращения и 5—8% от всех острых миелопатий, обусловливает гиподиагностику ишемической миелопатии и не позволяет провести крупные эпидемиологические и клинические исследования. Негативным следствием этого является отсутствие отечественных и зарубежных четких критериев и руководств по диагностике и лечению ИСМ [3].
Если магнитно-резонансная томография (МРТ) в различных модальностях (Т1, Т2, Т2 STIR, FLAIR, МР-спинальная ангиография) клинически признана золотым стандартом диагностики сосудистой миелопатии, то вопросы так называемого адекватного лечения остаются противоречивыми, а сама терапия остается в основном симптоматической [4].
Поэтому изучение новых терапевтических методик лечения ИСМ в экспериментальных условиях является актуальным направлением спинальной ангионеврологии [5, 6].
ИСМ, подобно церебральной ишемии и травме мозга, сопровождается как острыми (выброс провоспалительных цитокинов, оксидативный стресс, глутаматергическая эксайтотоксичность), так и вторично-опосредованными нейропатохимическими реакциями (кавитация, демиелинизация, апоптоз) [7]. В связи с этим является актуальным применение лекарственных препаратов, обеспечивающих непосредственную защиту нейронов спинного мозга от первичного и вторичного повреждения.
Поэтому особый интерес представляет исследование широко распространенного в неврологической практике лекарственного препарата кортексин, который показал свою эффективность при различных заболеваниях нервной системы [8]. Пептиды препарата содержат комплекс физиологически значимых водорастворимых полипептидов, амино- и рибонуклеиновых кислот, которые регулируют рост и дифференцировку нейронов, их функциональную стабильность и пластичность синаптических процессов. Являясь нейротрофическими и ростовыми факторами, эти соединения способны селективно связываться с нейротрофическими p75NTR- и Trk-рецепторами, реализуя элементы нейротрофической активности. Благодаря определенному набору активных L-аминокислот (глутаминовая и аспарагиновая, орнитин), обладающих высокой энергетической активностью, субстанции кортексина воздействует на разные мембранные и клеточные мишени в нейронах, корригируя определенные звенья патологического процесса в мозге. Таким образом, кортексин препятствует оксидативной деструкции клеток, корригирует синаптическую дезинтеграцию, защищает нейроны от разрушения, ограничивает воспалительный очаг за счет нивелирования провоспалительных цитокинов, нормализует поведенческие и когнитивные стереотипы [8]. Также показано, что препарат участвует в сохранении митохондриального потенциала, регуляции функции глутаматных рецепторов и концентрации внутриклеточного Са 2+ [9].
Учитывая направленность предшествовавших доклинических и клинических исследований кортексина на церебральную патологию, актуально изучение эффективности препарата в условиях экспериментальной ИСМ. Поэтому целью настоящего исследования стало изучение влияния лекарственного препарата кортексин на функциональное восстановление и морфологическую картину спинного мозга белых крыс с моделированной ИСМ.
Материал и методы
Исследование выполнено на 16 самцах крыс стока Wistar массой 300 г. Эксперимент проводился в соответствии с «Руководством по уходу и использованию лабораторных животных» (публикация Национального института здоровья № 85−23, США) и «Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ» [10]. Оперативные вмешательства проводились под общей анестезией хлоралгидратом (300 мг/кг), вводившимся внутрибрюшинно. Модель ИСМ осуществляли по описанной методике окклюзии кровотока в нижнем артериальном бассейне спинного мозга [11]: у анестезированных животных выполняли лапаротомию, выделяли и перевязывали инфраренальный отдел брюшной аорты (рис. 1). Операционную рану ушивали. Животных помещали в отдельные клетки.

Все экспериментальные животные были разделены на две группы: контрольную (n=8) и опытную (n=8). Крысам опытной группы вводили внутрибрюшинно кортексин в дозе 0,15 мг/кг за 30 мин до окклюзии инфраренального отдела аорты, исходя из суточной дозировки препарата для взрослых 10 мг 2 раза в день.
Двигательную функцию задних конечностей животных оценивали через 48 ч по шкале Тарлова. После оценки неврологического дефицита повторно наркотизировали животное, проводили перфузионную фиксацию тканей 4% раствором параформальдегида на фосфатном буфере. Затем послойно препарировали мягкие ткани спины и выделяли пояснично-крестцовый отдел позвоночника на уровне L2—S4. После ламинэктомии и пересечения спинномозговых корешков спинной мозг извлекали из позвоночного канала. Препарат подвергался стандартной гистологической обработке, после чего срезы толщиной 5 мкм окрашивали тионином по методу Ниссля. Подсчет нейронов, попавших в срез, проводили методом прямой микроскопии (Leica DM750) при увеличении 100 и 400. Отмечали количество нормохромных, гиперхромных, гипохромных, сморщенных нейронов и клеток-теней в основных клеточных группах передних рогов спинного мозга: передних и задних медиальных, передних и задних латеральных, а также в вентральных с обеих сторон [11].
Статистическая обработка результатов исследования проводилась путем сравнения двух независимых выборок с использованием непараметрического теста Манна—Уитни. Различия считались значимыми при р 
У крыс опытной группы, предварительно получивших кортексин, в пояснично-крестцовых сегментах отмечались легкие ишемические изменения в виде появления (в основном) гиперхромных нейронов на фоне преобладания нормохромных, без выраженных явлений отека и лизиса клеток. Визуальное морфологическое сравнение срезов спинного мозга контрольной и опытной групп представлено на рис. 3.

Сравнение цитоархитектоники срезов пояснично-крестцовых сегментов крыс обеих экспериментальных групп с использованием критерия Манна—Уитни показало, что в контрольной группе наблюдалось значимо большее количество гиперхромных сморщенных нейронов (р=0,0001) и клеток-теней (р=0,0003). В опытной группе животных, получивших кортексин, наблюдались преимущественно нормохромные нейроны (р=0,01) (рис. 4).

Обсуждение
Ишемические изменения в спинном мозге могут быть вызваны широким спектром патологических состояний, основными из которых являются: сосудистые факторы риска (атеросклероз, артериальная гипертензия, сахарный диабет), компрессионные факторы (дискогенная миелопатия), диссекция позвоночных артерий, сосудистые мальформации (в первую очередь спинальная дуральная артериовенозная фистула), фиброзно-хрящевая эмболия [5, 12]. Особое место среди причин сосудистой миелопатии занимает патология аорты и хирургические вмешательства на ней. По данным зарубежных исследователей [13], частота развития нижнего парапареза или плегии при операциях на аорте и ее крупных ветвях достигает 60%. Поэтому окклюзия аорты была взята за основу в экспериментальной модели ИСМ в настоящем исследовании.
За последние годы в условиях экспериментальной миелоишемии был доказан положительный эффект агонистов аденозиновых А2а-рецепторов, ингибиторов NMDA-рецепторов, эритропоэтина и его производных [14], факторов роста нервной ткани [15] и стволовых мезенхимальных клеток [14—16]. Миелопротективный эффект наблюдался в условиях умеренной гипотермии [16, 17] и гипербарической оксигенации [18].
Предложенные методы лечения, безусловно, имеют патогенетическую составляющую и способны оказывать нейропротективный эффект, однако использование большинства из них по-прежнему возможно исключительно в экспериментальных условиях и недоступно для клинической неврологии. Таким образом, актуальным в лечении сосудистой миелопатии и ее последствий представляется использование доступных средств, обладающих широким спектром патогенетических воздействий, каким является лекарственный препарат кортексин.
В настоящем экспериментальном исследовании с моделированием ИСМ у крыс путем окклюзии инфраренального отдела аорты миелопротективный эффект кортексина подтвержден как с функциональной, так и с морфологической точек зрения. В опытной группе животных, которым предварительно внутрибрюшинно вводился кортексин, отмечалась полная функциональная активность либо минимальная неврологическая симптоматика, соответствующая 4—4,5 балла по шкале Тарлова. При проведении гистологического исследования у крыс этой же группы в пуле клеток пояснично-крестцовых срезов спинного мозга преобладали нормохромные и гиперхромные нейроны, свидетельствующие о минимальных ишемических изменениях на фоне перевязки брюшной аорты. Полученные результаты статистически значимо отличались от показателей контрольной группы животных, в которой преобладали ишемически-опосредованные двигательные нарушения в виде глубоких задних парезов и изменения цитоархитектоники (появление гиперхромных сморщенных, гипохромных нейронов и клеток-теней).
Полученные в исследовании данные позволяют предполагать потенциальный миелопротективный эффект кортексина, связанный с его нейротрофическими свойствами, и рассматривать этот лекарственный препарат в контексте лечения сосудистой миелопатии.
Авторы выражают благодарность к.б.н., доценту Галине Юрьевне Юкиной, д.вет.н., доценту Марии Николаевне Мальцевой за помощь в проведении исследования.
Авторы заявляют об отсутствии конфликта интересов.
Источник