Привет студент
Спинной мозг крысы
Спиной мозг крысы
Спинной мозг — medulla spinalis (рис. 1, 2) — в виде цилиндрического тяжа, уплощенного дорсовентрально, тянется от первого шейного нерва до конца терминальной нити. Расположен в позвоночном канале позвоночного столба; краниально переходит в продолговатый мозг, их границей считается уровень большого (затылочного) отверстия. Спинной мозг подразделяется на сегменты, или части, соответствующие выходам определенных спинномозговых нервов. Различают шейную часть — pars cervicalis, грудную часть — pars thoracica, поясничную — pars lumbalis, крестцовую — Pars sacralis — и хвостовую часть — pars caudalis. На своем протяжении спинной мозг образует два утолщения — шейное и поясничное; они соответствуют области отхождения нервов грудной и тазовой конечностей. Шейное утолщение — intumescentia cervicalis (рис. 3) — ограничено V-VIII шейными позвонками и I грудным, поясничное утолщение — intumescentia lumbalis — I-IV поясничными позвонками. По мере продвижения в каудальном направлении спинной мозг уменьшается в диаметре, образуя мозговой конус — conus medullaris — конечный отдел спинного мозга, расположенный в крестце, содержащий крестцовые и хвостовые сегменты и переходящий в терминальную нить — filum terminale. Нить представляет собой тонкое продолжение глиальных и эпендимальных клеток конуса спинного мозга и его оболочек, идущее в хвост позади III хвостового нерва. На вентральной поверхности спинного мозга между вентральными канатиками расположена глубокая продольная срединная (вентральная) щель — fiss. mediana (ventr.), в которой проходит вентральная спинномозговая артерия. Кроме того, на вентральной поверхности заметна парная вентральная латеральная борозда — sul. lat. ventr., отделяющая вентральный канатик от латерального; из борозды выходят вентральные двигательные корешки спинномозговых нервов. По середине дорсальной поверхности тянется срединная (дорсальная) борозда — sul. me-dianus (dors.). Параллельно ей идет парная дорсальная латеральная борозда — sul. lat. dors., отделяющая дорсальный канатик от латерального; в борозду входят дорсальные чувствительные корешки спинномозговых нервов.
На поперечных разрезах спинного мозга — sectiones medullae spinalis (рис. 4) — отчетливо заметны характерные черты серого и белого вещества.
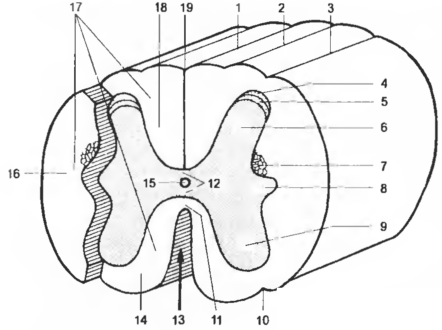
Серое вещество — substantia grisea — на поперечных разрезах на разных уровнях спинного мозга имеет очертание симметричных крыльев бабочки (или более или менее схоже с буквой Н) и располагается в центре среза. Обе ножки Н-образного серого вещества соединяются перемычкой — серой спайкой — commissura grisea, состоящей из многочисленных немиелинизированных волокон, проходящих в сером веществе, особенно дорсальнее центрального канала — can. centralis (рис. 4) (иногда носит название спинномозгового канала). На границе спинного и продолговатого мозга центральный канал расширяется и сообщается с полостью IV желудочка головного мозга. В канале различают две части: часть продолговатого мозга — pars medullaris — и спинномозговую часть — pars spinalis. В ростральном конце центрального канала находится особая область — самое заднее поле, входящее в состав околожелудочковых органов. На уровне перекреста пирамид первая часть переходит во вторую без каких-либо структурных изменений. В области мозгового конуса центральный канал расширяется и образует терминальный желудочек (Краузе) — ventriculus terminalis.
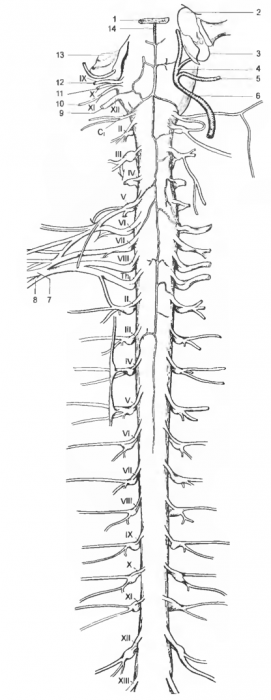
Риc. 1 Спинной мозг, шейные и грудные спинномозговые нервы
1 — os basisplienoidale, 2 — cavum tympani, 3 — bulla tympanica(вскрыт), 4 — a. carotis int., 5 — a. carotis ext., 6 — a. carotis communis, 7 n. medianus, 8 — n. thoracicus med., 9 — n. hypoglossus, 10 — n. accessorius, 11 — n. vagus, 12 — n. glossopharyngeus, 13 — cochlea, 14 — v. anteromediana; CI-VIII — nn. cervicales, TI-XIII — nn. tlioracici.
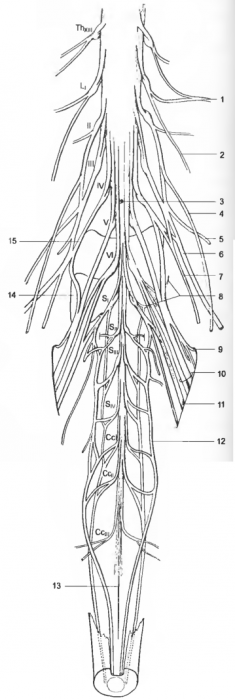
Рис. 2 Поясничные, крестцовые, хвостовые нервы и пояснично крестцовое сплетение
1 — n. iliohypogastricus, 2 — п. ilioinguinal is, 3 — medulla spinalis, 4 — n. genitofemoralis, 5 — n. cutaneus femoris lat., 6 — n. femoralis, 7 — n. obturatorius, 8 — rr. dors., 9 — incisura ischiadica, 10 — truncus lumbosacralis, 11 — n. pudendus et n. cutaneus femoris caud., 12 — truncus caud. ventr., 13 — filum terminale, 14 — ala sacralis, 15 — LIV: LI-VI — nn. lumbales, SI-IV — nn. sacrales, CcI-III — nn. coccygei.
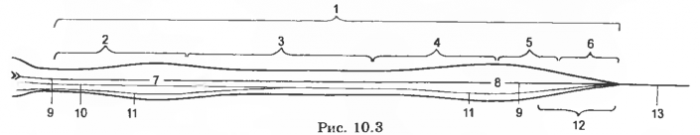
Рис. 3 Спинной мозг (схема) в дорсальной проекции
1 — medulla spinalis, 2 — pars cervicalis, 3 — pars thoracica, 4 — pars lumbalis, 5 — pars sacralis, 6 — pars caud., 7 — intumescentia cervicalis, 8 — intumescentia lumbalis, 9 — sul. medianus (dors.), 10 — sul. intermedius dors., 11 — sul. lat. dors., 12 — conus medullaris, 13 — filum terminale.
Рис. 4 Поперечный разрез спичного мозга ( схема )
1 — sul. medianus (dors.) 2 — sul. intermedius dors., 3 — sul. lat. dors. 4 — apex cornus dors., 5 — substantia gelatinosa, 6 — cornu dors., 7 — formatio reticularis, 8 — cornu lat., 9 — cornu ventr., 10— sul. lat. ventr., 11 — commissure alba, 12 — commissure grisea, 13 fiss. rnediana (ventr.), 14 — funiculus ventr., 15 — can. cen tralis, 16 — funiculus lat., 17 — funiculi medullae spinalis, 18 — funiculus dors., 19 —septum mediantim dors.
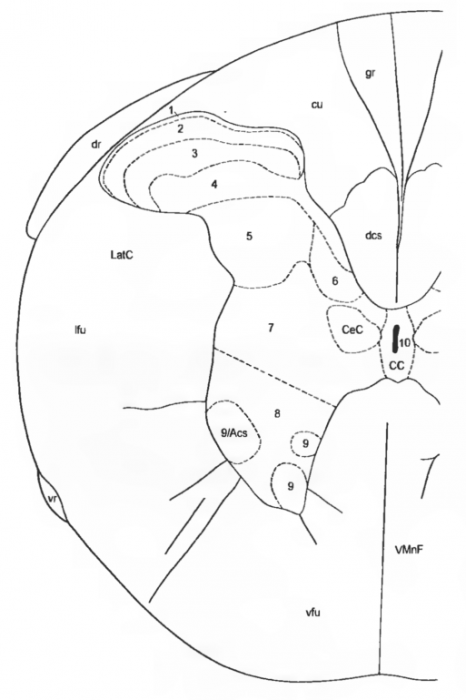
Рис. 5 Схема микрофотографии поперечного ( фронтального) среза спинного мозга (левая половина) на уровне I шейного сегмента (CI) gr — fasc. gracilis, cufasc. cuneatus, dcs — tr. corticospinalis dors., CeC — nucl. centralis cervicalis, CC — can. centralis. VMnF — fiss. mediana ventr., vfu — funiculus ventr., Acs nucl. accessorius (columna ventr.), vr — rad. ventr., Ifu — funiculus lat. Lat С — nucl. cervicalis lat., dr — rad. dors.; цифры 1-10 обозначают 10 слоев (пластине Рекседа — Rexed 1-10
В каждой половине спинного мозга серое вещество подразделяется на дорсальный рог — cornu dors., вентральный рог — cornu ventr. — и латеральный рог — cornu lat., которые на всем протяжении спинного мозга образуют продольные выступы — дорсаль ный, вентральный и латеральный столбы — columnae dors., ventr. et lat. В вентральной части дорсальных столбов сбоку располагается ретикулярная формация (вещество) — formatio (substantia) reticularis, представленная сочетанием белого и серого вещества, наибольшей выраженности достигает в шейной части.
Цитоархитектоническая организация серого вещества спинного мозга включает 10 слоев (пластинок), показанных впервые Рекседом (Rexed, 1952, 1954) на кошках. Аналогичное строение наблюдается у крыс. На схеме среза спинного мозга (рис. 5) представлена топография пластинок на урове CI.
Белое вещество — substantia alba (рис. 6) — расположено на периферии спинного мозга и серыми столбами разделяется на три пары обособленных участков — канатиков спинного мозга — funiculi medullae spinalis — дорсальных, латеральных и вентральных. Вентральные канатики соединены между собой белой спайкой — commissura alba — волокнами, переходящими между срединной (вентральной) щелью и серым веществом.
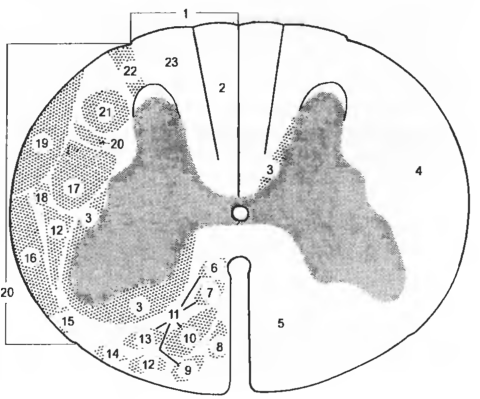
Рис. 6 Пути и пучки белого вещества спинного мозга
1 — funiculus dors., 2 — fasc. gracilis, 3 — fascc. proprii, 4 — funiculus lat., 5 — funiculus ventr., 6 — pars commissurospinalis, 7 — pars interstitiospinalis, 8 — tr. pyramidalis (corticospinalis) ventr., 9 — pars tectospinal is, 10 — pars reticulospinal is, 11 — fasc. longitudinalis med., 12 — tr. spinothalamicus, 13 — pars vestibulospinalis, 14 — tr. spinoolivaris, 15 — tr. spinotectalis, 16 — tr. spinocerebellaris ventr., 17 — tr. rubrospinalis, 18 — fibrae tectospinales lat., 19 — tr. spinocereebellaris dors., 20 — tr. reticulospinalis lat.,21 — tr. pyramidalis (cortico spinalis) lat., 22 — tr. dorsolat., 23 — fasc. cuneatus.
Проводящие пути делятся на 3 группы: собственные пути, которые связывают различные отделы спинного мозга между собой, восходящие пути, соединяющие спинной мозг с головным, и нисходящие пути, связывающие головной мозг со спинным.
Дорсальный канатик — funiculus dors. (рис. 6) — участок белого вещества между дорсальным рогом и дорсальной срединной бороздой; содержит восходящие пути. Дорсальные канатики обеих сторон разделены дорсальной срединной перегородкой — septum medianum dors. Медиальный сегмент дорсального канатика занимает тонкий пучок, или пучок Голля, — fasc. gracilis; относится к проводящим путям проприоцептивной и тактильной чувствительности. В латеральной части дорсального канатика проходит клиновидный пучок, или пучок Бурдаха, — fasc. cuneatus; несет информацию от мышечных рецепторов и механорецепторов кожи. Оба вышеописанных пучка обнаруживаются в шейном и грудном сегментах, а в поясничном и крестцовом — только тонкий пучок. В дорсальном канатике на границе с дорсальным рогом находятся также собственные пучки — fascc. proprii, соединяющие рядом расположенные сегменты.
Пирамидный (корково спинномозговой) путь — tr. pyramidalis (corticospinalis) — парный нисходящий проекционный нервный путь; входит в состав пирамидных путей, начинающихся в коре головного мозга и идущих к ядрам черепных нервов и к мотонейронам спинного мозга.
Латеральный канатик — funiculus lat. (рис. 6, см. рис. 5) — находится между дорсальным и вентральным рогами и отделен от дорсального и вентрального канатиков дорсальной и вентральной латеральными бороздами, соответственно. Канатик уменьшается в размерах от ростральных к каудальным участкам; содержит восходящие и нисходящие пути. Восходящие пути располагаются в наружных, периферических отделах канатика и включают; спинно-ретикулярный путь — tr. spinoreticularis, дорсальный спинно-мозжечковый путь, или пучок Флексига, — tr. spinocerebellaris dors., вентральный спинно мозжечковый путь, или пучок Говерса, tr. spinocerebellaris ventr., спинно-покрышечный — tr. spinotectalis спинно кольцевой — tr. spinoanularis и спинно таламический tr. spinothalamicus — пути.
Нисходящие пути латерального канатика располагаются в его внутренних частях и включают: красноядерно-спинномозговой путь, или пучок Монакова, — tr. rubrospinalis, латеральные покрышечно спинномозговые волокна — fibrae tectospinales lat. и
латеральный преддверно-спинномозговой путь (вестибулоспинальный), или пучок Гельда, или пучок Левенталя, — tr. vestibulospinalis lat. — нисходящий пучок экстрапирамидной системы.
Вентральный канатик — funiculus ventr. (рис. 6, см. рис. 5) — располагается между вентральной срединной щелью и вентральным рогом; содержит нисходящие проводящие пути. Основную часть канатика занимает медиальный продольный пучок — fasc. longitudinalis med.
Различают ретикулярноспинномозговой путь — tr. reticulospi nalis и медиальный преддверно спинномозговой (вестибулоспинальный) путь — tr. vestibulospinalis med.
Кроме того, выделяют и восходящий спинно-оливный путь — tr. spinoolivaris.
От спинного мозга в каждом его сегменте двенадцатью и более корешковыми нитями — fila radicularia — начинаются дорсаль ный корешок (чувствительный) — rad. dors, (sensoria) (см. рис. 5) и вентральный корешок (двигательный) — rad. ventr. (motoria) (см. рис. 5), которые затем объединяются в один смешанный метамерный (сегментный) спинномозговой нерв, выходящий из спинного мозга через соответствующее межпозвоночное отверстие позвоночного столба. В дорсальном корешке, у места его слияния с вентральным корешком в позвоночном канале, находится спинномозговой узел (чувствительный) — gnl. spinale (sensoriale). После слияния спинномозговой нерв отдает большую вентральную и меньшую дорсальную ветви. Кроме этого, отходят соединительные ветви — rr. communicantes — между спинномозговым нервом и симпатическим стволом и менингеальная ветвь — r. meningeus, снова уходящая в позвоночный канал. В шейных и грудных сегментах спинномозговые нервы отходят почти на уровне межпозво ночного отверстия. В поясничных сегментах место выхода корешков из спинного мозга находится краниальнее соответствующего позвоночного канала. В крестцовых и хвостовых сегментах нервы идут в каудальном направлении.
Скачать реферат: У вас нет доступа к скачиванию файлов с нашего сервера. КАК ТУТ СКАЧИВАТЬ
Источник
Нервные клетки спинного мозга крысы
Перспективным направлением в регенераторной клеточной терапии можно считать трансплантацию предшественников нейрональных клеток или нейрональных стволовых клеток (НСК), которые получают из нейроэпителия эмбриона [7]. Направленное культивирование СК приводит к их нейрональной дифференцировке. Нейрональные стволовые клетки (НСК) наиболее часто используются в экспериментальной трансплантации для лечения повреждений СМ. Пересадка региональных НСК в СМ крыс сопровождается выживанием и интеграцией с мозгом реципиента, а также дифференцировкой в нейроны и глию [3, 6]. Предшественники нейрональных клеток — идеальная мишень для окончательной дифференцировки и запуска аксонального роста. Достоверным контролем такой дифференцировки может служить формирование межсинаптических связей и наличие активных форм специализированных глутаматергических, серотонинергических, норадреналергических, глицинергических, холинергических, ГАМК-ергических нейротрансмиттеров [5, 8, 9].
Цель исследования — проведение гистологического и иммуногистохимического анализа восстановления структур спинного мозга половозрелых крыс в модели частичного его повреждения и трансплантации коллаген-хитозановой матрицы, содержащей предшественников нейрональных клеток и нейрональное микроокружение.
Материалы и методы исследования
Гистологический и иммуногистохимический анализ срезов спинного мозга при прямой имплантации клеточных нейрональных матриц в дислокацию спинальной травмы. Препараты спинного мозга получали путем тщательного и осторожного выделения ткани из позвоночного канала через 1-4 недели после операции. Спинной мозг помещали на 24 часа в 10 %-й раствор фосфат-забуференного формалина. Далее осуществляли классическую гистологическую проводку ткани на оборудовании фирмы Leica (Германия), часть гистологических срезов окрашивали гематоксилин-эозином с целью обзорного анализа ткани в месте дислокации имплантата и в его непосредственном окружении. При обзорной микроскопии гистологических срезов (продольных, косых, поперечных) оценивалась степень глиальной реакции в зоне травмы, окружающей ткани, состояние нейронов серого вещества спинного мозга. Оценивалось состояние белого и серого вещества спинного мозга в 5 полях зрения каждого среза. Подсчитывалось количество клеток макроглии (астроциты, олигодендроциты), микроглии (макрофаги) и количество клеток нейронального ряда [1]. Часть гистологических срезов подвергали иммуногистохимической обработке на предмет выявления состояния имплантированной клеточной массы (поиск трансплантированных клеток, экспрессирующих зеленый флюоресцентный белок GFP) на флюоресцентном микроскопе «Olympus BX-51» с применением программных продуктов «Applied Spectral Imaging» (USA).
Иммуноцитохимия. Детекция экспрессии маркеров (оценка способности дифференцироваться у трансплантированных клеток). Часть препаратов спинного мозга ресуспендировали и использовали для выделения клеточной массы. Клетки отмывали от фиксатора и к суспензии клеток добавляли 0,1 % раствор Тритона Х100 для пермобилизации мембран. Затем отмывали от Тритона 0,1 %-м раствором Твина 20 с последующей инкубацией в этом же растворе с добавлением 2 % нормальной сыворотки козы при комнатной температуре (для блокирования неспецифического связывания антител). Далее повторно отмывали последовательно растворами PBS и Твина 20, после чего добавляли первичные антитела к нейрофиламенту мыши (Abcam, USA) в разведении 1:100, смесь инкубировали 1 ч, затем снова отмывали, после чего добавляли раствор вторичных антител кролика с красной флюоресцентной меткой. Не связавшиеся молекулы метки отмывали трижды PBS и оценивали флюоресценцию на проточном цитометре Guava EasyCyte Mini (USA). Детекция по двум спектрам — зеленый (оценка наличия клеток с GFP), красный — наличие экспрессии нейрофиламента. Часть выделенной клеточной массы спинного мозга подвергали формальдегидной фиксации с последующей иммуноцитохимией клеток с помощью антител (все от Abcam, USA) против GFAP — глиального фибриллярного кислого белка (маркер астроцитов), нейрофиламента, олигодендроцитов и енолазы нейронов, против мышиных белков для исключения появления перекрестного сигнала. Выявление маркеров осуществляли методом согласно инструкции производителя антител. Ядра клеток окрашивали DAPI (0,1 мкг/мл) в течение 10 мин. Для получения изображений и анализа использовали флюоресцентный микроскоп «Olympus BX-51» и программные продукты «Applied Spectral Imaging» (USA). Для анализа каждого маркера выделяли 6 зон для проведения анализа и фотодокументации. Микроскопирование проводили по каждой зоне в 30 полях зрения. Параллельно проводили поиск на этих же препаратах GFP-меченных клеток. Таким образом, производили трехцветный флюоресцентный анализ — детекция зеленого свечения — GFP, красного свечения — маркера и синего свечения — ядер клеток. Наличие прижившихся после трансплантации клеток оценивали с помощью проточной флюориметрии в препаратах на 3 и 4 неделях после имплантации. Образцы спинного мозга диспергировали в 0,5 %-м растворе коллагеназы на PBS в течение 15-30 минут при 37 °С, фильтровали через нейлоновый фильтр, далее фиксировали 1 %-м раствором формалина на PBS и после отмывки окрашивали DAPI, производили оценку количества клеток, несущих синюю и зеленую (GFP) метку (*).
Результаты исследования и их обсуждение
Результаты детекции флюоресценции в образцах спинного мозга методом проточной цитометрии в сроки 1-2 недели. Анализ цитометриии показал, что прямая трансплантация предшественников нейрональных клеток, полученных путем культивирования и создания нейронального микроокружения, сохраняет предшественников нейронов жизнеспособными, которые пролиферируют в течение двух недель. Относительное количество клеток, экспрессирующих фактор GFP, не изменяется на протяжении двух недель и составляет около 34 % (рис. 1).
В имплантированной матрице с эмбриональными стволовыми клетками мыши (ЭСКм) с увеличением длительности срока имплантации отмечалось более выраженное рассасывание ее волокон. К 28 суткам большая часть стволовых клеток мигрировала на периферию матрицы, ближе к нервной ткани. Анализ препаратов показывает, что клетки в матрицах не только выживают, а, заполняя всю ее структуру, мигрируют по направлению к нервной ткани (рис. 2).
Более того, уменьшение количества волокон биополимера свидетельствует о высокой метаболической активности клеток в зоне репарации. Вокруг зоны травмы в обоих случаях (при наличии и отсутствии ЭСКм в матрице) выявлено большое количество макрофагов, цитоплазма которых заполнена фагоцитированным детритом (рис. 3). Количество клеток микроглии увеличивалось на 7-14-е сутки, на 21-28-е сутки — их количество уменьшалось.
Рис. 1. Проточная цитофлуориметрия диспергатов спинного мозга. Детекция зеленой флюоресценции (в красно-зеленой области):
а — контроль (без клеток); б — 3-я неделя с клетками; в — 4-я неделя с клетками;
б, в — наличие второго пика флюоресценции независимо от типа матриц

Рис. 2. Имплантированная матрица в зону спинальной травмы (14-е сутки):
а — отсутствие ЭСК; б — наличие ЭСК
При имплантации матрицы с ЭСКм отмечалось увеличение всех клеток макроглии (астроциты, олигодендроциты). При использовании матрицы без ЭСКм наблюдалось увеличение клеток олигодендроглии и уменьшение клеток астроцитарной глии.
Количество нейронов в сером веществе спинного мозга при имплантации матрицы с ЭСКм сохранялось примерно на одном уровне, с небольшим пиком на 2-3 неделях. Кроме того, на 28-е сутки вокруг зоны имплантации матрицы с ЭСКм отмечено появление большого количества клеток-предшественников нейрональной популяции (рис. 4). При отсутствии в матрице ЭСКм количество нейронов с течением времени уменьшалось. Таким образом, результаты исследований показали признаки возможного полноценного восстановления структуры поврежденного спинного мозга. Трансплантация клеток на матрице приводит к более полноценному и быстрому восстановлению гистологической целостности ткани после повреждения.
Рис. 3. Выраженная макрофагальная реакция в зоне спинальной травмы
на 7-е сутки после имплантации матрицы
Рис. 4. Малодифференцированные нейрональные клетки-предшественники в зоне имплантации матрицы на 28-е сутки
Иммуногистохимический анализ срезов спинного мозга. При иммуногистохимическом анализе фиксированных ЭСКм препаратов спинного мозга клетки предварительно обрабатывали антителами против нейрофиламента, с последующим мечением вторичными антителами и детекцией флюоресценции. Результаты анализа гистопрепаратов показали, что добавление в матрицу имплантата предшественников нейрональных клеток ведет к приживлению и миграции их в раневой зоне с последующей дифференцировкой в нейрональном направлении в независимости от состава матриц в течение 1-4 недель. Вероятно, ключевое влияние играет не только трехмерная структура носителя, но и цитокиновое окружение клеток в ране. У животных как в ранние сроки, так и в поздний период наблюдалось наличие трансплантированных клеток, дифференцирующихся в тканеспецифические типы. При дифференцировке клеток по нейрональному направлению в продольном срезе спинного мозга имеется наличие нейрофиламента в клеточных тяжах, енолазы, образование синапсов и GFP к глиальному белку (рис. 5). При выполнении анализа наличия енолазы в препаратах спинного мозга после обработки клеток антителами против енолазы и последующего мечения вторичными антителами с детекцией флюоресценции обнаруживается специфический белок нейрона. При обработке антителами против глиального кислого белка последний также обнаруживается в клеточной массе трансплантированных клеток.
При использовании в препаратах спинного мозга ЭСКм, обработанных антителами против олигодендроцитов, с последующим мечением вторичными антителами и детекцией флюоресценции последние обнаруживаются в зоне прямой трансплантации.
Анализ морфологии спинного мозга крыс указывает, что технология имплантации матриц в спинной мозг и их состав обеспечивают стабильность губчатой конструкции в течение 4-х недель, жизнеспособность пересаженных предшественников нейрональных и олигодендритных клеток, отсутствие выраженной воспалительной реакции в месте имплантации, формирование межсинаптических соединений при межклеточном контакте. Такая картина подтверждает субстратную реконструкцию спинного мозга в месте разрыва в виде вновь образованной нервной ткани [2, 4].
Исследование диспергатов спинного мозга показало, что в образцах присутствуют GFP-меченные клетки. Результаты иммуногистохимического анализа показывают стабильную экспрессию GFP на третьей и четвертой неделе после трансплантации в зону повреждения спинного мозга, что подтверждает способность трансплантированных клеток к хоумингу в зоне повреждения.
Рис. 5. Дифференцировка клеток по нейрональному направлению в продольном срезе спинного мозга:
а — экспрессия нейрофиламента, 2 недели, опыт; б — экспрессия енолазы, 2 недели, опыт;
в — наличие синапсов на аксональных окончаниях пересаженных клеток, экспрессия GFP, опыт;
г — наличие GFP к глиальному белку, опыт
Далее были проанализированы образцы гистологических препаратов на наличие маркеров нейрональной дифференцировки и восстановление нормальных синаптических межклеточных связей. Результаты флуоресцентной микроскопии показывают, что трансплантированные клетки экспрессируют маркеры олигодендроцитов и нейрофиламента, образуя межсинаптические связи. На препаратах с трансплантированными клетками встречаются меченные против нейрофиламента клетки, что указывает на дифференцировку в данном направлении перенесенных ЭСКм.
Исследование маркеров на олигодендроциты показало, что клетки формируют характерные морфологические структуры. Наличие зеленого свечения подтверждает, что трансплантированные клетки функционируют и дифференцируются в олигодендроциты. Пересаженная клеточная трехмерная конструкция способна создавать условия для дифференцировки трансплантированных на матрице ЭСКм в нейрональном и глиальном направлениях.
Заключение
Таким образом, результаты, полученные в ходе выполнения исследований, позволяют полагать, что коллаген-хитозановая матрица, содержащая в своем составе факторы нейрогенной дифференцировки и предшественники нейрональных клеток, пригодна для имплантации с целью восстановления функций поврежденного спинного мозга без риска образования тератом при условии культивирования клеточной массы ЭСКм в условиях искусственно созданного трехмерного окружения. Полученные результаты соответствуют мировому уровню и расширяют знания о механизмах дифференцировки ЭСК в культуре.
Исследования выполнены при поддержке гранта ГОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф.Войно-Ясенецкого» МЗ СР РФ (2009), грантов государственного фонда содействия развитию малых форм предприятий в научно-технической сфере (проект №6746р/9167 от 10.04.2009 г. и проект № 8775 р/13993 от 11.01.2011 г.).
Рецензенты:
Манчук В.Т., д.м.н., профессор, директор НИИ медицинских проблем Севера СО РАМН, г. Красноярск;
Савченко А.А., д.м.н., профессор, зав. лабораторией молекулярно-клеточной физиологии и патологии НИИ медицинских проблем Севера СО РАМН, г. Красноярск.
Источник