Нейроны спинного мозга крысы где ядрышко
Перспективным направлением в регенераторной клеточной терапии можно считать трансплантацию предшественников нейрональных клеток или нейрональных стволовых клеток (НСК), которые получают из нейроэпителия эмбриона [7]. Направленное культивирование СК приводит к их нейрональной дифференцировке. Нейрональные стволовые клетки (НСК) наиболее часто используются в экспериментальной трансплантации для лечения повреждений СМ. Пересадка региональных НСК в СМ крыс сопровождается выживанием и интеграцией с мозгом реципиента, а также дифференцировкой в нейроны и глию [3, 6]. Предшественники нейрональных клеток — идеальная мишень для окончательной дифференцировки и запуска аксонального роста. Достоверным контролем такой дифференцировки может служить формирование межсинаптических связей и наличие активных форм специализированных глутаматергических, серотонинергических, норадреналергических, глицинергических, холинергических, ГАМК-ергических нейротрансмиттеров [5, 8, 9].
Цель исследования — проведение гистологического и иммуногистохимического анализа восстановления структур спинного мозга половозрелых крыс в модели частичного его повреждения и трансплантации коллаген-хитозановой матрицы, содержащей предшественников нейрональных клеток и нейрональное микроокружение.
Материалы и методы исследования
Гистологический и иммуногистохимический анализ срезов спинного мозга при прямой имплантации клеточных нейрональных матриц в дислокацию спинальной травмы. Препараты спинного мозга получали путем тщательного и осторожного выделения ткани из позвоночного канала через 1-4 недели после операции. Спинной мозг помещали на 24 часа в 10 %-й раствор фосфат-забуференного формалина. Далее осуществляли классическую гистологическую проводку ткани на оборудовании фирмы Leica (Германия), часть гистологических срезов окрашивали гематоксилин-эозином с целью обзорного анализа ткани в месте дислокации имплантата и в его непосредственном окружении. При обзорной микроскопии гистологических срезов (продольных, косых, поперечных) оценивалась степень глиальной реакции в зоне травмы, окружающей ткани, состояние нейронов серого вещества спинного мозга. Оценивалось состояние белого и серого вещества спинного мозга в 5 полях зрения каждого среза. Подсчитывалось количество клеток макроглии (астроциты, олигодендроциты), микроглии (макрофаги) и количество клеток нейронального ряда [1]. Часть гистологических срезов подвергали иммуногистохимической обработке на предмет выявления состояния имплантированной клеточной массы (поиск трансплантированных клеток, экспрессирующих зеленый флюоресцентный белок GFP) на флюоресцентном микроскопе «Olympus BX-51» с применением программных продуктов «Applied Spectral Imaging» (USA).
Иммуноцитохимия. Детекция экспрессии маркеров (оценка способности дифференцироваться у трансплантированных клеток). Часть препаратов спинного мозга ресуспендировали и использовали для выделения клеточной массы. Клетки отмывали от фиксатора и к суспензии клеток добавляли 0,1 % раствор Тритона Х100 для пермобилизации мембран. Затем отмывали от Тритона 0,1 %-м раствором Твина 20 с последующей инкубацией в этом же растворе с добавлением 2 % нормальной сыворотки козы при комнатной температуре (для блокирования неспецифического связывания антител). Далее повторно отмывали последовательно растворами PBS и Твина 20, после чего добавляли первичные антитела к нейрофиламенту мыши (Abcam, USA) в разведении 1:100, смесь инкубировали 1 ч, затем снова отмывали, после чего добавляли раствор вторичных антител кролика с красной флюоресцентной меткой. Не связавшиеся молекулы метки отмывали трижды PBS и оценивали флюоресценцию на проточном цитометре Guava EasyCyte Mini (USA). Детекция по двум спектрам — зеленый (оценка наличия клеток с GFP), красный — наличие экспрессии нейрофиламента. Часть выделенной клеточной массы спинного мозга подвергали формальдегидной фиксации с последующей иммуноцитохимией клеток с помощью антител (все от Abcam, USA) против GFAP — глиального фибриллярного кислого белка (маркер астроцитов), нейрофиламента, олигодендроцитов и енолазы нейронов, против мышиных белков для исключения появления перекрестного сигнала. Выявление маркеров осуществляли методом согласно инструкции производителя антител. Ядра клеток окрашивали DAPI (0,1 мкг/мл) в течение 10 мин. Для получения изображений и анализа использовали флюоресцентный микроскоп «Olympus BX-51» и программные продукты «Applied Spectral Imaging» (USA). Для анализа каждого маркера выделяли 6 зон для проведения анализа и фотодокументации. Микроскопирование проводили по каждой зоне в 30 полях зрения. Параллельно проводили поиск на этих же препаратах GFP-меченных клеток. Таким образом, производили трехцветный флюоресцентный анализ — детекция зеленого свечения — GFP, красного свечения — маркера и синего свечения — ядер клеток. Наличие прижившихся после трансплантации клеток оценивали с помощью проточной флюориметрии в препаратах на 3 и 4 неделях после имплантации. Образцы спинного мозга диспергировали в 0,5 %-м растворе коллагеназы на PBS в течение 15-30 минут при 37 °С, фильтровали через нейлоновый фильтр, далее фиксировали 1 %-м раствором формалина на PBS и после отмывки окрашивали DAPI, производили оценку количества клеток, несущих синюю и зеленую (GFP) метку (*).
Результаты исследования и их обсуждение
Результаты детекции флюоресценции в образцах спинного мозга методом проточной цитометрии в сроки 1-2 недели. Анализ цитометриии показал, что прямая трансплантация предшественников нейрональных клеток, полученных путем культивирования и создания нейронального микроокружения, сохраняет предшественников нейронов жизнеспособными, которые пролиферируют в течение двух недель. Относительное количество клеток, экспрессирующих фактор GFP, не изменяется на протяжении двух недель и составляет около 34 % (рис. 1).
В имплантированной матрице с эмбриональными стволовыми клетками мыши (ЭСКм) с увеличением длительности срока имплантации отмечалось более выраженное рассасывание ее волокон. К 28 суткам большая часть стволовых клеток мигрировала на периферию матрицы, ближе к нервной ткани. Анализ препаратов показывает, что клетки в матрицах не только выживают, а, заполняя всю ее структуру, мигрируют по направлению к нервной ткани (рис. 2).
Более того, уменьшение количества волокон биополимера свидетельствует о высокой метаболической активности клеток в зоне репарации. Вокруг зоны травмы в обоих случаях (при наличии и отсутствии ЭСКм в матрице) выявлено большое количество макрофагов, цитоплазма которых заполнена фагоцитированным детритом (рис. 3). Количество клеток микроглии увеличивалось на 7-14-е сутки, на 21-28-е сутки — их количество уменьшалось.
Рис. 1. Проточная цитофлуориметрия диспергатов спинного мозга. Детекция зеленой флюоресценции (в красно-зеленой области):
а — контроль (без клеток); б — 3-я неделя с клетками; в — 4-я неделя с клетками;
б, в — наличие второго пика флюоресценции независимо от типа матриц

Рис. 2. Имплантированная матрица в зону спинальной травмы (14-е сутки):
а — отсутствие ЭСК; б — наличие ЭСК
При имплантации матрицы с ЭСКм отмечалось увеличение всех клеток макроглии (астроциты, олигодендроциты). При использовании матрицы без ЭСКм наблюдалось увеличение клеток олигодендроглии и уменьшение клеток астроцитарной глии.
Количество нейронов в сером веществе спинного мозга при имплантации матрицы с ЭСКм сохранялось примерно на одном уровне, с небольшим пиком на 2-3 неделях. Кроме того, на 28-е сутки вокруг зоны имплантации матрицы с ЭСКм отмечено появление большого количества клеток-предшественников нейрональной популяции (рис. 4). При отсутствии в матрице ЭСКм количество нейронов с течением времени уменьшалось. Таким образом, результаты исследований показали признаки возможного полноценного восстановления структуры поврежденного спинного мозга. Трансплантация клеток на матрице приводит к более полноценному и быстрому восстановлению гистологической целостности ткани после повреждения.
Рис. 3. Выраженная макрофагальная реакция в зоне спинальной травмы
на 7-е сутки после имплантации матрицы
Рис. 4. Малодифференцированные нейрональные клетки-предшественники в зоне имплантации матрицы на 28-е сутки
Иммуногистохимический анализ срезов спинного мозга. При иммуногистохимическом анализе фиксированных ЭСКм препаратов спинного мозга клетки предварительно обрабатывали антителами против нейрофиламента, с последующим мечением вторичными антителами и детекцией флюоресценции. Результаты анализа гистопрепаратов показали, что добавление в матрицу имплантата предшественников нейрональных клеток ведет к приживлению и миграции их в раневой зоне с последующей дифференцировкой в нейрональном направлении в независимости от состава матриц в течение 1-4 недель. Вероятно, ключевое влияние играет не только трехмерная структура носителя, но и цитокиновое окружение клеток в ране. У животных как в ранние сроки, так и в поздний период наблюдалось наличие трансплантированных клеток, дифференцирующихся в тканеспецифические типы. При дифференцировке клеток по нейрональному направлению в продольном срезе спинного мозга имеется наличие нейрофиламента в клеточных тяжах, енолазы, образование синапсов и GFP к глиальному белку (рис. 5). При выполнении анализа наличия енолазы в препаратах спинного мозга после обработки клеток антителами против енолазы и последующего мечения вторичными антителами с детекцией флюоресценции обнаруживается специфический белок нейрона. При обработке антителами против глиального кислого белка последний также обнаруживается в клеточной массе трансплантированных клеток.
При использовании в препаратах спинного мозга ЭСКм, обработанных антителами против олигодендроцитов, с последующим мечением вторичными антителами и детекцией флюоресценции последние обнаруживаются в зоне прямой трансплантации.
Анализ морфологии спинного мозга крыс указывает, что технология имплантации матриц в спинной мозг и их состав обеспечивают стабильность губчатой конструкции в течение 4-х недель, жизнеспособность пересаженных предшественников нейрональных и олигодендритных клеток, отсутствие выраженной воспалительной реакции в месте имплантации, формирование межсинаптических соединений при межклеточном контакте. Такая картина подтверждает субстратную реконструкцию спинного мозга в месте разрыва в виде вновь образованной нервной ткани [2, 4].
Исследование диспергатов спинного мозга показало, что в образцах присутствуют GFP-меченные клетки. Результаты иммуногистохимического анализа показывают стабильную экспрессию GFP на третьей и четвертой неделе после трансплантации в зону повреждения спинного мозга, что подтверждает способность трансплантированных клеток к хоумингу в зоне повреждения.
Рис. 5. Дифференцировка клеток по нейрональному направлению в продольном срезе спинного мозга:
а — экспрессия нейрофиламента, 2 недели, опыт; б — экспрессия енолазы, 2 недели, опыт;
в — наличие синапсов на аксональных окончаниях пересаженных клеток, экспрессия GFP, опыт;
г — наличие GFP к глиальному белку, опыт
Далее были проанализированы образцы гистологических препаратов на наличие маркеров нейрональной дифференцировки и восстановление нормальных синаптических межклеточных связей. Результаты флуоресцентной микроскопии показывают, что трансплантированные клетки экспрессируют маркеры олигодендроцитов и нейрофиламента, образуя межсинаптические связи. На препаратах с трансплантированными клетками встречаются меченные против нейрофиламента клетки, что указывает на дифференцировку в данном направлении перенесенных ЭСКм.
Исследование маркеров на олигодендроциты показало, что клетки формируют характерные морфологические структуры. Наличие зеленого свечения подтверждает, что трансплантированные клетки функционируют и дифференцируются в олигодендроциты. Пересаженная клеточная трехмерная конструкция способна создавать условия для дифференцировки трансплантированных на матрице ЭСКм в нейрональном и глиальном направлениях.
Заключение
Таким образом, результаты, полученные в ходе выполнения исследований, позволяют полагать, что коллаген-хитозановая матрица, содержащая в своем составе факторы нейрогенной дифференцировки и предшественники нейрональных клеток, пригодна для имплантации с целью восстановления функций поврежденного спинного мозга без риска образования тератом при условии культивирования клеточной массы ЭСКм в условиях искусственно созданного трехмерного окружения. Полученные результаты соответствуют мировому уровню и расширяют знания о механизмах дифференцировки ЭСК в культуре.
Исследования выполнены при поддержке гранта ГОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф.Войно-Ясенецкого» МЗ СР РФ (2009), грантов государственного фонда содействия развитию малых форм предприятий в научно-технической сфере (проект №6746р/9167 от 10.04.2009 г. и проект № 8775 р/13993 от 11.01.2011 г.).
Рецензенты:
Манчук В.Т., д.м.н., профессор, директор НИИ медицинских проблем Севера СО РАМН, г. Красноярск;
Савченко А.А., д.м.н., профессор, зав. лабораторией молекулярно-клеточной физиологии и патологии НИИ медицинских проблем Севера СО РАМН, г. Красноярск.
Источник
Нейроны спинного мозга крысы где ядрышко
Целью исследования явилось изучение клеточного состава и морфометрических показателей слоев переднетеменной зоны коры головного мозга половозрелых крыс-самцов.
Материалы и методы исследования
Исследования проводились на 20 белых беспородных половозрелых крысах-самцахмассой 200–250 г, на 8–10-й неделе постнатального онтогенеза. Животные забивались путем декапитации под наркозом смеси эфира с хлороформом (1:1) с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации, и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных.
Материалом для исследования служили участки коры головного мозга крыс, выделяемые согласно цитоархитектоническим картам [1;4].Фиксацию мозга осуществляли 10%-нымраствором формалина, приготовленном на 0,2 М фосфатном буфере, и смесью Карнуа. При отсутствии макроскопическивидимых повреждений органа делали продольный срез на уровне продолговатого мозга. Парафиновые срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином для обзорных целей, а для изучения цитоархитектоники – метиленовым синим по Нисслю.
Исследования препаратов проводились с помощью цифрового микроскопа MT 4000 SeriesBiologicalMicroscope с программным обеспечением для анализа изображений BioVisionVersion 4.0. Фотосъемку препаратов производили с помощью встроенной цифровой камеры при увеличении 10×10, 40×10 и 100×10.Разрешение полученных изображений1280×1024 пикселей.
Результаты исследования и их обсуждение
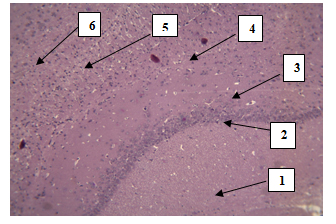
При гистологическом исследованиинеокортексабелой крысы обнаружено 6 слоев нервных клеток, снаружи внутрь располагающиеся в следующем порядке:1)молекулярный слой; 2) наружный зернистый слой; 3) наружный пирамидный слой; 4) внутренний зернистый слой; 5) внутренний пирамидный слой; 6) полиморфный слой (рис. 1).
Исследования показали, что молекулярный слой содержит редкие нейроны слегка вытянутой или овальной формы диаметром 4,19±0,51 мкм. Средняя площадь клетки составляет 21,07±1,19 мкм. Нейроны содержат мелкие ядра площадью 8,24±0,53 мкм2 и диаметром 1,36±0,23 мкм. Цитоплазма клетки имеет мелкозернистую структуру. Основной объем молекулярного слоя составляют отростки – аксоны и дендриты. Толщина слоя составляет 88,44±0,94 мкм (рис. 2, табл.1).
Рис. 1.Кора больших полушарий головного мозга крыс.Окраска гематоксилином и эозином. Стрелками обозначены слои нервных клеток (снизу вверх: 1–молекулярный; 2-наружный зернистый; 3-наружный пирамидный; 4-внутренний зернистый; 5-внутренний пирамидный; 6-полиморфный). Ув. 10×10
Рис. 2. Молекулярный слой коры больших полушарий. Стрелкой обозначены нейроны молекулярного слоя коры больших полушарий (НМС). Окраска гематоксилином и эозином. Ув. 100×10
Наружный зернистый слой образован крупными нейронами диаметром 10,11±0,43 мкм, имеющими округлую и пирамидальную форму. Средняя площадь клеток 74,58±1,92 мкм2. Нейроны содержат ядра слегка вытянутой или овальной формы площадью 22,47±0,91 мкм2и диаметром 4,69±0,44 мкм. Цитоплазма клетки имеет крупнозернистую структуру. Клетки расположены плотно, образуя четко отделяющийся слой,толщиной 62,81±0,46 мкм (рис. 3, табл.1).
Наружный пирамидный слой представлен немногочисленными пирамидными нейронами конической формы площадью 27,14±0,67 мкм2, диаметром 6,87±0,48 мкм. Нейроны содержат мелкие ядра, имеющие округлую форму. Средняя площадь ядер слоя составляет 8,82±0,47 мкм2, диаметр 4,14±0,39 мкм.Цитоплазма клеток имеет гладкую, незернистую структуру. Толщина слоя 119,18±1,74 мкм (рис. 4, табл.1).
Рис. 3. Наружный зернистыйслой коры больших полушарий. Стрелкой обозначены нейроны наружного зернистого слоя (НЗК). Окраска гематоксилином и эозином. Ув. 100×10
Рис. 4. Наружный пирамидный слой коры больших полушарий. Стрелками обозначены пирамидные нейроны (ПН). Окраска гематоксилином и эозином. Ув. 100×10
Внутренний зернистый слой содержит мелкие звездчатые клетки площадью 31,60±1,14 мкм2 и диаметром 5,93±0,43 мкм. Ядра перикарионов округлой формы, имеют четко выраженную структуру. Средняя площадь ядер 8,82±0,47 мкм2, диаметр 2,18±0,32 мкм. Цитоплазма в клетке распределена равномерно, без крупных белковых включений. Толщина слоя 664,38±0,66 мкм (рис. 5, табл.1).
Внутренний пирамидный слой представлен крупными нейронами (клетки Беца, клетки Мейнерта) и небольшим количеством звездчатых клеток. Клетки Беца самые крупные нейроны коры площадью 149,31±1,18 мкм2 и диаметром 13,66±0,89 мкм, которые дают начало миелиновым волокнам пирамидного тракта.
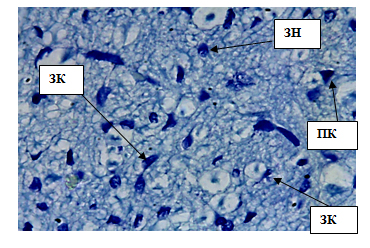
Рис. 5. Внутренний зернистый слой коры больших полушарий. Стрелкой обозначены звездчатые клетки (ЗК), пирамидные клетки (ПК), зернистые нейроны(ЗН). Окраска метиленовым синим по Нисслю. Ув. 100×10
Цитоплазма не содержит включений, ядра крупные, площадью 28,83±0,61 мкм2, диаметром 6,34±0,57 мкм. Клетки Бецаимеют длинный апикальный дендрит, выходящий из вершины пирамиды в вышележащие слои, и другие дендриты, отходящие сбоку и от основанияперикариона. От основания пирамиды отходит аксон, уходящий в белоевещество(рис. 6, табл.1). Клетки Мейнерта – достаточно крупные нейроны, локализованные на протяжении всего V слоя коры полушарий.Средняя площадь клеток 86,13±0,96 мкм2, диаметр 9,23±0,40 мкм. Клетки имеют пирамидную форму, однако по сравнению с клетками Беца лишены крупных апикальных и боковых дендритов, ихядра относительно крупные, округлые, площадью 16,59±0,67 мкм2. Средняя толщина внутреннего пирамидного слоя составляет 285,61±0,99 мкм. Перикарионы звездчатых нейронов имеют округлую, полигональную или треугольную форму, 9–14 мкм в диаметре (рис. 7).
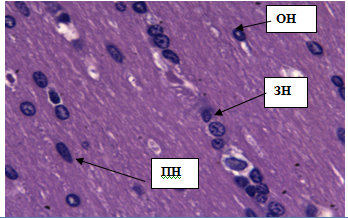
Полиморфный слой образован множеством нейронов различной величины и формы, а также некоторым количеством пирамидных и зернистых нейронов (рис.8). Клетки располагаются цепочками. Пирамидные нейроны имеют слегка вытянутую форму с заметными удлинениями, площадь которых 71,97±1,55 мкм2.Ядра небольшие с ровной структурой, площадью 11,83±0,45 мкм2. Зернистые нейроны имеют округло-угловатую форму размером от 74–77 мкм. Цитоплазма с крупными белковыми включениями, придающими зернистость внутреннему содержимому клетки. Ядра клеток вытянутые, площадью 16,08±0,92 мкм2, диаметром 5,15±0,36 мкм.
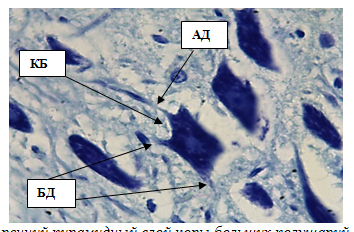
Рис. 6. Внутренний пирамидный слой коры больших полушарий. Стрелками обозначены:клетки Беца (КБ), апикальный дендрит (АД), боковые дендриты (БД). Окраска метиленовым синим по Нисслю.Ув. 100×10
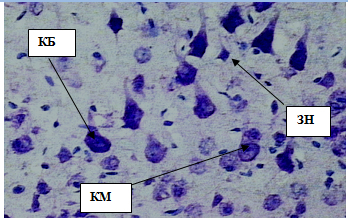
Рис. 7. Внутренний пирамидный слой коры больших полушарий. Стрелками обозначены:клетки Беца (КБ), клетки Мейнерта (КМ), звездчатые нейроны (ЗН). Окраска метиленовым синим по Нисслю. Ув. 40×10
Морфометрические показатели нейронов коры головного мозга
Источник