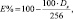Призматический эпителий почки крысы
В настоящее время острый панкреатит (ОП) занимает ведущее место в структуре патологии поджелудочной железы [2, 5, 6, 7, 10]. Актуальность темы обусловлена частотой заболеваемости, продолжительностью лечения, высоким уровнем послеоперационной летальности при деструктивных формах панкреатита. Это составляет не только медицинский, но и социально-экономический аспекты проблемы. Развитие острого панкреатита не ограничивается отдельным поражением поджелудочной железы. Внеорганные осложнения представлены нарушением функций сердечно-сосудистой системы, легких, печени и почек, являясь причиной летальных исходов при остром панкреатите [4]. Панкреатит сопровождается развитием тяжелой эндогенной интоксикации, при этом почки быстро вовлекаются в патологический процесс и не справляются со своей функцией уже на ранних стадиях заболевания, что приводит к прогрессированию эндотоксикоза [5].
Цель исследования – изучить морфологические изменения внутренних органов крыс (поджелудочной железы и почек) при ОП, вызванные холодовой травмой.
Материалы и методы исследования. Модель ОП создавали на 30 беспородных белых крысах обоего пола массой 180–220 г путем криовоздействия на селезеночный сегмент поджелудочной железы хлорэтилом по Канаяну А.С. [3] в соответствии с «Правилами проведения работ с использованием экспериментальных животных».
До и после операции грызуны находились на стандартном лабораторном рационе при неограниченном количестве воды. У 25 опытных крыс в асептических условиях под эфирным наркозом после выполнения верхнесрединной лапаротомии производили мобилизацию поджелудочной железы. Селезеночный сегмент железы и селезенку вывихивали в лапаротомную рану и отграничивали от брюшной полости полиэтиленовой пленкой. Длительность криовоздействия хлорэтилом составляла около 1 минуты – до образования инея на поверхности охлаждаемого участка. Через 2-3 минуты пораженный участок поджелудочной железы спонтанно оттаивал. Последующее исследование аутоптатов внутренних органов (поджелудочная железа, почки) проводили через 1 час и на 1-3-7-14-е сутки после операции. 5 лабораторных животных служили контролем морфологического изучения. Исследования пораженных органов крыс производили с помощью световой микроскопии, срезы аутоптатов были окрашены гематоксилином и эозином и по Ван-Гизону. Электронномикроскопическое исследование проводили на микроскопе JEM-100 C по общепринятым методикам.
Результаты. При микроскопическом исследовании поджелудочной железы было установлено, что в ней развивался острый деструктивный панкреатит с образованием фокусов некроза, демаркационного воспаления, которые были наиболее выражены через сутки после операции. К 14-м суткам в местах альтерации паренхимы поджелудочной железы начинала формироваться созревающая грануляционная ткань.
У интактных крыс в почках при световой микроскопии наблюдали почечные тельца округлой формы, просвет капсулы Шумлянского-Боумена свободный. Эпителиальные клетки образуют щелевидные пространства. При электронной микроскопии в клетках проксимальных извитых канальцев ядро круглой формы с оформленным гетерохроматином. Митохондрии овальные с четким рисунком крист. Пиноцитозные пузырьки создают «вспененный» вид; микроворсинки, образующие щеточную каемку, расположены параллельно друг другу. Базальная мембрана незначительной толщины (рис. 1).
Рис. 1. Проксимальный извитой каналец интактной крысы. Базальная мембрана незначительной толщины. Микроворсинки, образующие щеточную каемку, расположены параллельно друг другу. Базальный лабиринт хорошо выражен. х 5000
Морфологическое изучение почек в различные сроки после операции по моделированию острого панкреатита выявило следующие изменения.
Через 1 час эксперимента в почках развивались слабовыраженные дегенеративные изменения паренхиматозных элементов. Почечные тельца округлой формы. Мочевое пространство не расширено. Эпителий извитых и прямых канальцев с признаками слабо выраженной, местами умеренно выраженной белковой дистрофии. Сосуды мозгового слоя почек умеренно полнокровны.
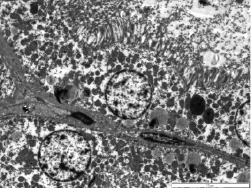
Через 24 часа с начала эксперимента по моделированию острого панкреатита в почках существенные структурные изменения произошли в сосудах и канальцевом аппарате. Отмечалось полнокровие сосудов микроциркуляторного русла с наличием стазов в отдельных из них и выраженная белковая дистрофия эпителия извитых канальцев с белковыми цилиндрами в просвете некоторых канальцев. При электронномикроскопическом исследовании в клетках проксимального извитого канальца обнаружены патологические изменения: отсутствовала щёточная каёмка, ядра эпителиальных клеток в состоянии пикноза, митохондрии мелкие, различной формы: округлые, вытянутые, изогнутые. Базальный лабиринт разрушен. Видны белковые включения в просвете дистального канальца. Между канальцами отмечен гемолиз эритроцитов.
На 3-и сутки дистрофические изменения в почках увеличились. Клетки проксимального извитого канальца определяются по типичному «вспененному» виду вследствие наличия в них большого количества вакуолей. Ядра овальные. Митохондрии вытянутые, кристы плохо читаются. Видны белковые включения в просвете проксимальных извитых канальцев. Базальная мембрана отекшая, слабо различим базальный лабиринт.
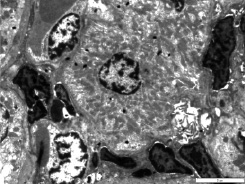
К 7-м суткам в почках появились дистрофические изменения эпителия прямых канальцев, в просвете которых имеются белковые включения. Стенка проксимального извитого канальца выстлана однослойным кубическим эпителием, ядра клеток которого округлые, видны ядрышки, электронноплотный гетерохроматин сосредоточен вблизи кариолеммы (рис.2). Митохондрии различной формы (овальные и округлые), плохо читаются крипты. В просвете проксимального извитого канальца хаотически расположенные микроворсинки щеточной каемки. Базальная мембрана отекшая, базальный лабиринт разрушен. Наличие значительного количества мезангиальных клеток, продуцирующих базальную мембрану. Присутствие макрофагов, обладающих фагоцитарными и фибробластическими свойствами, подтверждает дегенеративные изменения, происходящие в нефронах. Стенки сосудов утолщены за счет разрастающихся коллагеновых волокон, просвет капилляров сужен из-за «подушкообразных» выпячиваний ядер эндотелиоцитов.
Рис. 2. Почки крысы на 7 сутки острого панкреатита. Проксимальный извитой каналец, в просвете которого расположены разрушенные ворсинки щеточной каемки. В интерстициальном пространстве значительное количество мезангиальных клеток и макрофагов. х 4000
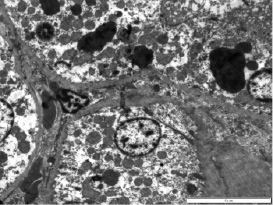
На 14-е сутки в почках наблюдается тенденция к уменьшению патологических изменений. Почечные тельца округлой формы, капиллярные петли умеренного кровенаполнения. Капсула Шумлянского–Боумена не утолщена. Мочевое пространство не расширено. Проксимальные извитые канальцы в состоянии слабо выраженной гиалиново-капельной дистрофии. Ядро клетки проксимального извитого канальца имеет овальную форму, видны ядрышки, гетерохроматин диффузно расположен. Митохондрии крупные, набухшие, округлой формы, слабо выражены кристы. Базальная мембрана отекшая, базальный лабиринт практически разрушен (рис.3). Отмечается гипертрофия мезангиальных клеток отдельных нефронов. Эпителий прямых канальцев в состоянии слабо выраженной гиалино-капельной дистрофии. Просвет канальцев дистального отдела нефронов сужен. Наблюдается склерозирование сосудов мозгового слоя почек.
Обсуждение. Нами выявлены морфологические закономерности вовлечения в патологический процесс «органа-мишени» – почек при ОП в эксперименте.
В отличие от данных других авторов [1, 3, 4] патологические изменения в клубочках почек экспериментальных животных были выражены слабо и ограничивались лишь дистрофическими процессами канальцевого аппарата и расстройствами кровообращения в сосудах микроциркуляторного русла. Нарушения метаболически активной части почек – канальцев, были связаны с развитием синдрома системного воспалительного ответа, который не ограничивался тканями поджелудочной железы, а носил характер множественной органной дисфункции с вовлечением в патологический процесс других жизненно важных органов (легкие, сердце, почки, печень) [3]. Изменения со стороны почек проявляются в первую очередь нарушением почечной микроциркуляции с нарастающими процессами дистрофии и альтерации клеточных элементов. В результате возникшей ишемии в почках наблюдаются процессы дегенерации почечных канальцев, что подтверждается данными Kriz et al. [8], Schwartz M.M., Bidani [9], Widdson A. L. [10]. Присутствие большого количества мезангиальных клеток и макрофагов создает условия для пролиферации молодой соединительной ткани в канальцевом аппарате почек [1].
Рис. 3. Почки крысы на 14 сутки острого панкреатита. Проксимальные извитые канальцы с многочисленными белковыми включениями и единичными круглыми митохондриями. Базальный лабиринт разрушен. х 5000
Таким образом, причиной структурных повреждений внутренних органов при остром панкреатите является воспалительная реакция системного характера, ведущая в итоге к развитию полиорганной недостаточности.
При развитии панкреатита на фоне эндогенной интоксикации происходит нарушение микроциркуляторного кровообращения и поражение канальцевого аппарата почек крыс. Наиболее явными показателями ультраструктурных изменений нефронов являются: разрушение базального лабиринта клеток проксимальных извитых канальцев, фрагментирование микроворсинок щеточной каемки, увеличение размеров митохондрий и нарушение рисунка крист, что замедляет способность клеток к репаративной регенерации. Присутствие значительного количества мезангиальных клеток и макрофагов указывает на развитие дистрофических процессов в почках экспериментальных животных. Эти признаки тубуло-интерстициального нефроза вместе с поражением поджелудочной железы ведут к развитию панкреато-ренального синдрома.
Примененная в эксперименте криомодель может быть использована для изучения патогенеза острого панкреатита и поиска новых методов лечения, а также определения эффективности лекарственных препаратов во взаимосвязи с функционально-метаболическим статусом почек.
Источник
Призматический эпителий почки крысы
Стресс эндоплазматического ретикулума (ЭР-стресс) представляет собой нарушение нормального фолдинга и накопление в просвете эндоплазматического ретикулума (ЭПР) аберрантных несвернутых или неправильно свернутых протеинов. Нарушение созревания белковых молекул ведет к прекращению нормального функционирования клетки и угрожает ей гибелью. Для нормального созревания белка необходимо определенное соотношение между биосинтетической нагрузкой и функциональной вместимостью ЭПР. Для обеспечения этого равновесия в клетках выработался сложный комплекс эволюционно сохраненных высокоспецифичных сигнальных путей, получивших наименование UPR (unfolded protein response) [4]. С биохимической точки зрения UPR представляет собой комплекс диверсифицированных, но тесно взаимосвязанных сигнальных ветвей, объединенных общим тригерным механизмом [2]. Этот механизм представлен мембранными белками – киназами PERK и IRE1, а также фактором транскрипции ATF6. Их регуляторные домены погружены в просвет ЭПР и связаны с шапероном BiP (binding immunoglobulin protein – белок, связывающий иммуноглобулины). Это один из наиболее изученных шаперонов ЭПР, относится к подсемейству белков теплового шока (Hsp70), также обозначается как GRP78 (glucose-regulated protein – белок, регулируемый глюкозой). При возрастании нагрузки на ЭПР содержание свободных шаперонов в его просвете падает и GRP78 отделяется для выполнения своей основной функции – защиты созревания белка. Таким образом, центральная регуляторная роль в запуске адаптивной ветви UPR принадлежит шаперону GRP78 (BiP) [4].
В случае продолжительного или чрезмерного ЭР-стресса клетка следует по пути запрограммированной гибели, подвергаясь апоптозу. Этот процесс индуцируется протеином GADD153 (growth arrest and DNA damage inducible genes – белок, вызывающий прекращение роста и повреждение ДНК), также известном как CHOP (CCAAT/enhancer-binding protein-homologus protein). Активированный CHOP индуцирует ряд генов, кодирующих участвующие в апоптозе протеины, такие как GADD34 и TRB3. Также CHOP подавляет экспрессию антиапоптозного гена bcl-2 и транскрипцию соответствующего протеина, что ведет к усилению оксидативного стресса и апоптоза [14, 9].
Современные данные позволяют рассматривать дисфункцию ЭПР и развитие ЭР-стресса как общее звено многих заболеваний человека, в том числе патологии почек. Несмотря на значительное количество работ, посвященных изучению ЭР-стресса в почке при ряде заболеваний (врожденные и наследственные заболевания, поликистоз почек, гломерулонефриты, диабетическая нефропатия, повреждение, вызванное ишемией/реперфузией, воздействием ряда лекарственных препаратов, солями тяжелых металлов), в литературе недостаточно освещены вопросы развития ЭР-стресса и его проявления при нефролитиазе.
Ранее нами получены данные, свидетельствующие о развитии оксидативного повреждения на ранних сроках литогенеза [5] и нарушении синтеза в почке белков-модуляторов процессов кристаллизации [3] факторов, доказанно вызывающих ЭР-стресс. Это позволило предположить, что процессы литогенеза могут сопровождаться развитием ЭР-стресса в клеточных элементах почки с нарушением их патофизиологии, микро- и ультраструктурной организации. Для оценки потенциальной роли ЭР-стресса в повреждении клеточных элементов почки на ранних сроках литогенеза мы провели сравнительное исследование биомаркеров ЭР-стресса (GRP-78 и GADD153) у крыс с экспериментальным нефролитиазом.
Цель данного исследования – оценить ультраструктурные изменения канальцевого и тубулярного эпителия почки и влияние стресса эндоплазматического ретикулума на процессы литогенеза при экспериментальном оксалатном нефролитиазе.
Материалы и методы исследования
Экспериментальная модель оксалатного нефролитиаза была выполнена на 80 сертифицированных самцах крыс линии Wistar массой тела от 180 до 250 г.
Все животные были разделены на четыре группы по 20 крыс в каждой. Крысы первой группы находились на общевиварном рационе, для питья получали водопроводную воду, мочекаменная болезнь у них не инициировалась. Данная группа использовалась в качестве контрольной. Животные второй группы на фоне стандартной диеты в течение 21 дня получали в качестве питья 1 % водный раствор этиленгликоля в свободном доступе, что индуцировало развитие оксалатного экспериментального нефролитиаза [11]. Животные третьей группы находились в условиях стандартной диеты в течение 42 дней и получали для питья 1 % раствор этиленгликоля. В четвертой группе животных в течение 3 недель моделировали экспериментальный нефролитиаз, в последующие 3 недели на фоне продолжающегося приема этиленгликоля животные получали с пищей α-токоферол в дозе 300 мг/кг.
Для гистологического исследования животных декапитировали путем дислокации шейного позвонка под эфирным наркозом с соблюдением требований Европейской конвенции «О защите позвоночных животных, используемых для экспериментальных или других научных целей» (Страсбург, 1986 г.), и Федерального закона Российской Федерации «О защите животных от жестокого обращения» от 01.01.1997. Материалом исследования служила почка крысы. Орган фиксировали в 10 % растворе формалина, обрабатывали по стандартной методике, заливали в парафин. Поперечные срезы через почечный сосочек толщиной 6 мкм окрашивали гематоксилином и эозином.
Для выявления отложений соединений кальция использовали импрегнацию серебром по методу Косса. Оценивали характер отложения и распределения кальциевых депозитов, их средние размеры, особенности локализации в тканях почки.
Для определения экспрессии маркеров адаптивной (белок GRP78) и дизадаптивной (GADD153) ветвей ЭР-стресса применяли непрямой двухшаговый стрептавидин-биотиновый метод с контролем специфичности реакции. После стандартной процедуры депарафинизации и регидратации выполняли блокирование эндогенной пероксидазы согласно рекомендациям производителя антител (Santa Cruz, USA). Восстановление антигенной специфичности производилось с помощью предварительной обработки срезов, погруженных в цитратный буфер (рН 6,0) в микроволновой печи при мощности 600 Вт 3 раза по 7 минут [1]. В качестве первичных антител использовали антитела к GRP78 (N-20: sc-1050), 1:50 и антитела к GADD153 (F-168: sc-575), 1:100 фирмы Santa Cruz (USA). Продукты реакции визуализировали с помощью системы Goat ABC Staining system: sc-2023 (Santa Cruz), Rabbit ABC Staining system: sc-2018 (Santa Cruz) и диаминобензидина (ДАБ).
Для электронно-микроскопического исследования образцы почки фиксировали в 4 % растворе параформальдегида, приготовленном на среде Хенкса, затем в 1 % растворе ОsO4 на фосфатном буфере (pH = 7,4), дегидратировали в этиловом спирте возрастающей концентрации и заключали в эпон. Полутонкие срезы толщиной 1 мкм окрашивали толуидиновым синим, изучали под световым микроскопом. Ультратонкие срезы толщиной 35–45 нм изготавливали на ультратоме Leica EM UC7, контрастировали насыщенным водным раствором уранилацетата и цитратом свинца и изучали в электронном микроскопе JEM 1400 («Jeol») при ускоряющем напряжении 80 кВ.
Морфометрические исследования проводили с использованием программных пакетов ImageJ 1.43 и AxioVision 3.4LE. Степень экспрессии (в баллах – 1+, 2+, 3+) оценивали по интенсивности окрашивания диаминобензидина (ДАБ). Для удобства интерпретации результатов рассчитывали интенсивность экспрессии по формуле
где E % – интенсивность экспрессии; 256 – максимум интенсивности окраски; Dx – интенсивность окрашивания ДАБ. Статистическую обработку полученных данных проводили с использованием пакета R версии 2.12 (лицензия GNU General Public License) для Microsoft Windows®. Межгрупповые различия оценивали по критерию Дана. Результаты работы представлены в виде значений 
Результаты исследования и их обсуждение
У животных контрольной группы наблюдали нормальную гистологическую картину строения коркового и мозгового вещества почки. Размер просвета собирательных трубок составил в среднем 15,5 ± 0,53 мкм. Кальциевые депозиты у крыс интактной группы гистохимически не были верифицированы. Ультраструктурные изменения в эпителиоцитах канальцев и собирательных трубок не выявлялись. Ядра клеток имели округлую форму с оформленным гетерохроматином. Расширений элементов и нарушений структуры гранулярной эндоплазматической сети (грЭПС) не отмечали. Визуализировались овальные митохондрии с правильно расположенными, четкими кристами, базальная мембрана незначительной толщины.
Иммуногистохимическое исследование показало умеренно выраженную (2+) экспрессию GRP78 в цитоплазме эпителиальных клеток канальцев нефрона и эпителиоцитах собирательных трубок. Экспрессия GADD153 была слабо выраженной (1+).
После 3 недель моделирования оксалатного нефролитиаза в почках крыс наблюдались дистрофические изменения эпителия канальцев и собирательных трубок в виде гидропической дистрофии, расширение просвета собирательных трубок (19,3 ± 0,41 мкм). В просвете собирательных трубок выявлялся слущенный эпителий и белковые депозиты.
В эпителии канальцев и собирательных трубок, в интерстиции мозгового вещества, в просветах собирательных трубок в составе белковых цилиндров обнаруживались умеренные отложения соединений кальция (в среднем 17,1 ± 2,00 в поле зрения). Характерной являлась локализация соединений кальция – преимущественно в области основания и средней трети почечного сосочка. Средний размер депозитов составил 9,2 ± 0,43 мкм. В 10 % наблюдений обнаруживались довольно крупные микролиты (размером до 38,5 мкм) с обтурацией просвета собирательных трубок и инкрустацией их эпителия соединениями кальция.
Электронно-микроскопическое исследование выявило ультраструктурные изменения эпителиоцитов канальцевой системы почки и собирательных трубок, затрагивающие клеточные органеллы, ядра и клеточные мембраны. Светооптические изменения эпителиоцитов по типу гидропической дистрофии электронно-микроскопически проявлялись расширением цистерн грЭПС и формированием различного размера вакуолей. Содержимое большинства из них было электронно-светлым, на поверхности мембран определялись одиночные, неравномерно расположенные рибосомы. Отмечались умеренные изменения митохондрий в виде набухания, нарушения целостности внутренней мембраны, нарушения правильного расположения крист. Ультраструктурные изменения в большей степени затрагивали апикальные части клеток; базальные полюса эпителиоцитов страдали в меньшей степени. Микроворсинки апикальной части клеток несколько сглаживались, но обычно сохранялись. Цитоплазма и отдельные увеличенные митохондрии содержали мелкие электронно-плотные депозиты кальция. Эндоплазматическая сеть таких клетках была значительно расширена. Ядра отдельных клеток выглядели сморщенными, с признаками кариорексиса и кариолизиса; в цитоплазме визуализировались лизосомы с ламеллярным содержимым, иногда аутофагосомы. Наблюдалось разрыхление базальной мембраны.
Иммуногистохимическое исследование показало умеренно выраженную (2+) экспрессию GRP78 эпителием почечных канальцев, статистически значимо не отличавшуюся от показателей интактных животных. Однако в участках интенсивного литогенеза экспрессия шаперона GRP78 была выраженной (3+), что на 34,8 % превышало показатели здоровых животных. Отмечена активация проапоптозной ветви ЭР-стресса: выраженная (3+) экспрессия GADD153 (на 32,4 % превышающая показатели контрольной группы, p
Источник