- Антикоагулянты – лучшее средство от крыс
- Принцип действия антикоагулянтов
- Виды антикоагулянтов в приманках Valbrenta
- Как пользоваться?
- Виды отравляющих приманок
- Болезни домашних крыс
- Паразитарные болезни
- Онкология у крыс
- Респираторный синдром у крыс
- Зубные проблемы у крыс
- Аллергия у крыс
- Как вызвать ратолога на дом
- Основные результаты научно-исследовательской работы и перспективы химиопрофилактики рака
- Достижения и перспективы химиопрофилактики рака
- Основные результаты научно-исследовательской работы
- Доклиническое и клиническое изучение антиканцерогенной активности синтетических и природных веществ
- Доклиническое и клиническое изучение противоопухолевой активности фармакологических веществ и препаратов
Антикоагулянты – лучшее средство от крыс
Антикоагулянты – вид токсичных веществ, обладающих отсроченным действием и позволяющих массово уничтожать вредителей. После того как грызун съедает приманку, он не замечает симптомов отравления, поэтому продолжает употреблять отравленную пищу в течение 3–4 дней, пока не наступает смерть.
Антикоагулянты опасны для человека и теплокровных животных. Поэтому дератизацию в целях безопасности лучше доверить профессионалам
Принцип действия антикоагулянтов
После того как яд попадает в организм вредителя, постепенно начинают меняться процессы свертывания крови (коагуляции), нарушается метаболизм. Печень перестает синтезировать протромбин, ответственный за свертывание. Это происходит за счет того, что необходимый для синтеза витамин К1 угнетается идентичным ему по химической структуре антикоагулянтом. В результате большинство отравленных грызунов гибнет от внутренних кровотечений из-за повышенной проницаемости сосудов.
Виды антикоагулянтов в приманках Valbrenta
- I поколения.Зоокумарин. Эффективен, если вредитель съедает приманку несколько раз в течение минимум 2–3 дней.
- II поколения. Хлорофасинон, бромадиолон, дифенакум, бродифакум. Максимально токсичны. Летальный исход вызывает даже одна доза. Препараты с ними – самые эффективные.
Борьба с крысами – комплексный процесс, включающий в себя установку ловушек, регулярную их проверку и пополнение
Как пользоваться?
Ядовитые приманки с антикоагулянтами применяют на любых объектах – в складах, квартирах, домах, дачах, больницах и поликлиниках. Также их используют на улице – в полях, на огородах, приусадебных участках.
Отраву создают самостоятельно, смешивая жидкие/гелиевые препараты с пищевой основой, или приобретают в готовом виде. Размещают – в коробках/лотках – в местах обитания и миграции вредителей, в углах, вблизи нор, иногда и в норы. Наиболее часто:
- У погрузочных и весовых площадок, мусоросборников.
- По периметру зданий, в укромных местах (под конструкциями, в нишах).
Главное правило – раскладывать отраву в перчатках. Крысы осторожны, и запах человека может отпугнуть их от приманки. Ее наличие проверяют через 2 дня после раскладки, затем раз в неделю. На место исчезнувших порций кладут новые. Завершают дератизацию, когда приманки очень долго остаются нетронутыми.
Людей, живущих и работающих на объекте обработки, обязательно извещают о разложенных приманках
Виды отравляющих приманок
- Гель для изготовления приманок. Добавляют в основной пищевой продукт (например, зерно). Раскладывают мини-порциями (до 30–50 г) на расстоянии 2–10 м.
- Жидкий концентрат для изготовления приманок. Вводят в привлекательный для грызунов продукт. Часто им обрабатывают печенье, хлеб, зерно.
- Мягкие брикеты. Самое эффективное средство против крыс – из-за тестообразной формы и привлекательных ароматизаторов.
- Твердые (восковые) брикеты. Идеальны в борьбе с мелким грызунами. Из-за водоотталкивающих свойств подходят для улицы и влажных помещений.
- Зерновые приманки. В помещениях раскладывают порциями по 10–15 г через каждые 3–5 м. При раскладке в норы в полях и садах сверху присыпают землей.
- Гранулированные приманки. В полях рассыпают после уборки урожая или весной, когда корма у грызунов мало. В помещениях используют в любое время года.
- Пена с антикоагулянтом. Наносят на подложки и в труднодоступные места, в том числе на вертикальные поверхности – в каналы, на трубы, в проемы и щели стен. При распылении в норы присыпают землей. Сохраняет форму не менее двух недель.
По соображениям безопасности, в частных домах и на участках используют готовые к применению брикеты, гранулы и зерновые приманки.
Для защиты домашних животных и птиц отраву раскладывают в закрытые деревянные кормушки или специальные приманочные домики в местах скопления вредителей.
Получить консультацию и купить средства с антикоагулянтами для уничтожения вредителей вы можете в нашем интернет-магазине.
Источник
Болезни домашних крыс
Наиболее часто встречаются такие болезни, как глистные инвазии, кокцидиоз, эктопаразиты (власоеды, блохи, чесоточные клещи).

Паразитарные болезни
Наиболее часто встречаются такие болезни, как глистные инвазии, кокцидиоз, эктопаразиты (власоеды, блохи, чесоточные клещи).
Глисты у крыс
Глисты поражают в основном кишечник, но есть виды, обитающие в печени, почках и мышечной ткани. Некоторые представители имеют цикл развития, затрагивающие легкие. В любом случае нельзя исключать глистов никогда. Вновь приобретенное животное должно быть обработано антигельминтными средствами для грызунов. В дальнейшем профилактически стоит давать препарат 2 раза в год при клеточном содержании и 3-4 раза в год, если зверька вывозят на дачу.
При поражении глистами (гельминтами) происходит нарушение процесса пищеварения, снижается усвояемость корма. У животного владельцы отмечают прогрессирующее исхудание, ухудшение качества шерстного покрова (появление перхоти, периодический зуд, ломкость волоса, участки облысения), чередование диареи и запора, наличие в кале крупинок, зернышек или волосков. Лечение: дача внутрь антигельминтиков для грызунов строго по инструкции, исходя из массы зверя на момент обработки.
Наружные паразиты крыс
Эктопаразиты обитают на поверхности коже, так и в глубоких слоях дермы. Для оценки последних необходимо делать глубокие соскобы в количестве не менее 5 штук с разных локализаций на границе здорового и пораженного участка. Не всегда удается точно идентифицировать принадлежность паразита, но в любом случае действуют согласно общеприянтой схеме – обработка инсектоакарицидными препаратами, выпускаемые в виде капелек или спрея (фирмы Beaphar, 8 in 1, Stronghold), а также препараты ивермектинового ряда, например ивермек, используемый инъекционно.
Кокцидии у крыс
Кокцидиоз – заболевание, вызываемое паразитов Е. falciformis, относящимся к паразитическим простейшим. Они обладают узкой специфичностью, поэтому заболевание крыс это неопасно для человека. Обитают они в эпителиальных клетках кишечника и, размножаясь, вызывают разрушение их. Клинические признаки при данном заболевании – цикличное нарушения стула, прогрессирующее истощение животного, наличие в кале крови и слизи.
Для диагностики – сдается кал на паразитов. Лечение сводится к применению кокцидиостатиков, сульфаниламидных препаратов, симптоматической терапии, направленной на устранения обезвоживания, применению питательных растворов и пр.
Онкология у крыс
К сожалению, крысы среди грызунов занимают первое место по встречаемости новообразований. Связано это с тем, что долгое время эти милые зверьки использовались в качестве лабораторных животных, поэтому их генотип нарушен. Встречается рак в любом возрасте, но чаще всего это животные старше 2 лет. Локализация может быть различна: это и неоплазии моечных желез, опухолевое перерождение липом (образований из жировой ткани), кожные новообразования. Лечение опухолей только оперативное – удаление.
Возможность, риск и способ проведения операции определяется специалистом после осмотра животного и сбора всей необходимой информации. У животных старше 1,5 лет рекомендуется предварительный биохимический анализ крови как минимальное исследование. Порой риск операции высок. Существует ряд послеоперационных осложнений, например резкое ускорение роста опухоли с поражением новых тканей. Возможно применение препаратов, сдерживающих рост опухолевых клеток, но эффективность их не всегда высокая.
Респираторный синдром у крыс
Встречается в любом возрасте при ухудшении условий содержания или как сопутствующее явление при других патологиях. Характеризуется усилением выработки порфирина, выделяющегося из ноздрей и глаз, свистом при дыхании, кашлем и снижением общей активности. Объясняется это активизацией условно патогенной микрофлоры, в частности микоплазмы, обитающей у всех представителей семейства мышиные.
Лечение сводится к применению курса антибиотиков, гомеопатических средств, направленных на поддержание работы респираторной и иммунной системы. Всегда необходимо бережное обращение с животным, улучшение качества жизни (условий обитания и кормления).
Зубные проблемы у крыс
Защечные зубы крыс, как правило, не перерастают. Может наблюдаться Неправильный рост резцов с травмированием слизистой оболочки щек, губ и неба. При этом происходит отекание слизистой оболочки, усиление слюноотделения, снижение потребления корма, исхудание животного, образование абсцессов на фоне заноса бактериальной микрофлоры. Лечение заключается в коррекции резцов, местных антисептических обработках ротовой
полости, насильном раскорме и при начале гнойного воспаления – антибиотикотерапии. Владельцы должны контролировать рост зубов у своих питомцев, обеспечивать их кормом с достаточной плотностью для обеспечения правильного стачивания.
Аллергия у крыс
Повышенная чувствительность организма у крыс наблюдается на продукты питания, покусы насекомыми, внешние частички (пыль, опилки, аэрозоли). Крысы могут поедать все, что им не предложат. но это не значит, что их рацион должен дублировать рацион человека. При неправильном кормлении продолжительность жизни составляет 1-1,5 года (что и наблюдается у диких крыс – пасюков).
А вот при соблюдении норм кормления длительность жизни крысы возрастает до 3-4 лет, а то и более. В настоящее время разработаны специальные сбалансированные корма для декоративных крыс, обеспечивающие надлежащее качество шерстного покрова, стачивание зубов и стабильную работу всех систем. Не стоит экономить на кормлении крыс, если вы хотите им счастливой жизни.
При аллергических реакциях на укусы паразитов необходимо животных обрабатывать специальными каплями, спреями и провести дезинсекцию всех частей клетки. При реакции на компоненты воздуха – необходимо поместить домик зверька в наиболее чистое и хорошо вентилируемое помещение.
Как вызвать ратолога на дом
Это наиболее, но далеко не единственные примеры заболеваний крыс. Но независимо от того, генетические это болезни, ятрогенные или по вине владельцев – необходимо зверька обследовать, а уже после этого делать какие-то прогнозы. Для вызова специалиста на дом Вы можете позвонить по телефону нашей Службы – 927-10-84.
Источник
Основные результаты научно-исследовательской работы и перспективы химиопрофилактики рака
Достижения и перспективы химиопрофилактики рака
С середины 80-х годов 20 века в лаборатории предклинических испытаний, наряду с работами прикладного характера, определилось самостоятельное научное направление по разработке проблемы химиопрофилактики опухолей (В.Г. Беспалов, В.А. Александров), основываясь на современных принципах, которые практически не изменились до сих пор. Разработка средств для химиопрофилактики рака является сложным и длительным процессом, который должен проходить следующие этапы: доклиническое изучение антиканцерогенной активности на моделях опухолей различных органов и оценка возможных токсических свойств, предварительное клиническое изучение эффективности и безопасности у относительно небольшого числа пациентов из групп повышенного риска злокачественных опухолей, итоговое клиническое изучение на больших контингентах пациентов с оценкой онкологической заболеваемости и смертности. Перспективными для химиопрофилактики рака являются вещества, обладающие выраженным антиканцерогенным действием на широком спектре экспериментальных моделей опухолей, не имеющие токсических свойств, показавшие эффективность и безопасность в клинических исследованиях.
Цель химиопрофилактики – поиск эффективных средств (природных и синтетических), способных тормозить или препятствовать возникновению и развитию опухолей и внедрение наиболее активных препаратов в клиническую практику.
Средства для профилактики рака должны отвечать следующим основным требованиям:
- доказанная в клинических испытаниях эффективность;
- возможность применения в течение длительного времени – многолетнего или даже постоянного в течение всей жизни;
- отсутствие токсических эффектов и побочных действий или минимальная токсичность, чтобы риск возможных осложнений при использовании онкопрофилактического препарата был допустимым в сравнении со снижением риска возникновения рака;
- желательны дополнительные благоприятные свойства, достигаемые в более короткие сроки;
- лекарственные формы должны быть преимущественно для перорального применения, в некоторых случаях – местными для нанесения на кожу и слизистые оболочки.
Усилия в разработке этой проблемы были сосредоточены на поиске препаратов, способных ингибировать канцерогенез при их использовании, в основном, в период постинициации, т.е. в фазу промоции и прогрессии опухолей. Именно такой подход является наиболее перспективным для химиопрофилактики рака, поскольку показания к применению антипромоторных препаратов необычайно широки: среди популяции практически здоровых лиц, живущих в экологически неблагоприятных условиях; в группах с высоким риском развития рака; среди больных с преопухолевыми заболеваниями; у онкологических больных в период ремиссии после проведенного радикального лечения.
С первых шагов разработки проблемы химиопрофилактики рака решалась важная и трудоемкая задача по отработке моделей опухолей (как злокачественных, так и доброкачественных), вызываемых с достаточно высокой частотой в течение относительно непродолжительного времени (не более 1–1,5 лет), особенно тех локализаций, которые относятся к наиболее распространенным. В итоге в лаборатории были освоены, а также разработаны новые оригинальные экспериментальные модели всех основных опухолей, встречающихся у человека (табл. 1). Кроме того, в лаборатории была разработана модель опухолей молочной железы, эндокринной и репродуктивной систем и других органов, индуцированных гамма-облучением, у крыс; многоорганные модели канцерогенеза, вызываемого химическими канцерогенами.
Таблица 1. Экспериментальные модели предрака и рака, применяемые в лаборатории, для изучения антиканцерогенных средств
Локализация
Метод индукции
Гистологический тип
МНМ интраммамарно, МНМ или ДМБА в/в у крыс
Инициация МНМ в/в + промоция тестостероном в/б у крыс
Простатическая интраэпителиальная неоплазия, аденокарциномы
МХ интратрахеально у крыс, уретан в/б у мышей
АОМ п/к у крыс и мышей, МНМ интраректально у крыс
Очаги аберрантных крипт, аденокарциномы
МБНА или ЭЭНС п/о
Плоскоклеточные карциномы, папилломы
ДЭНА в/б у крыс и мышей
Пренеопластические очаги, гепатоцеллюлярные карциномы
ДМБА + ТПА или БП накожно
Плоскоклеточные карциномы, папилломы
Глиомы головного и спинного мозга, невриномы периферических нервов
АОМ – азоксиметан, БП – бензо(а)пирен, ДЭНА – N-диэтилнитрозоамин, ДМБА – 7,12-диметилбенз(а)антрацен, МБНА — N-метил-N-бензилнитрозамин, МНМ – N-метил-N-нитрозомочевина, МННГ – N-метил-N-нитро-N’-нитрозогуанидин, МХ – 3-метилхолантрен, ТПА – 12-О-тетрадеканоилфорбол 13-ацетат, ЭНМ – N-этил-N-нитрозомочевина, ЭЭНС – этиловый эфир N-нитрозосаркозина; в/б – внутрибрюшинно, в/в – внутривенно, п/к – подкожно, п/о – перорально
Основные результаты научно-исследовательской работы
Доклиническое и клиническое изучение антиканцерогенной активности синтетических и природных веществ
К настоящему времени на различных моделях опухолей изучено более 80 веществ, и из них более 50 проявило антиканцерогенную активность, основные из которых представлены в табл. 2. В результате проведенной работы впервые выявлен ряд новых антиканцерогенных веществ, у известных ингибиторов установлена способность тормозить развитие опухолей ранее неизвестных локализаций.
Таблица 2. Ингибиторы канцерогенеза, изученные в лаборатории
Класс соединений
Препараты и вещества
Ретинол, альфа-токоферол, аскорбиновая кислота, тиамин, рибофлавин, витаминно-минеральные комплексы
Бета-каротин обычный и липосомальный
Селенит натрия, молибдат натрия, цинка сульфат
Нестероидные противовоспалительные средства
Диазепам, дифенин, карбонат лития
Тималин, тимоген, эпиталамин, кортексин
Органические кислоты и их соли
Фумаровая кислота, глюкарат кальция, глюкуронат калия
Биотехнологические растительные препараты
Экстракты лекарственных растений
Betula pendula, Eleutherococcus senticosus, Filipendula ulmaria, Glycyrrhiza glabra, Plantago major, Rhaponticum cartamoides, Urtica dioica
Пищевые вещества и природные комплексы
Концентрат ламинарии, масло зародышей пшеницы, пренолы из хвои, провитаминный концентрат из хвои, оксигумат торфяной, отруби пшеницы, рыбий жир, хвойный комплекс, экстракт фукусный
На основании полученных результатов по всем испытанным веществам на разных моделях были сделаны важные общие выводы:
- Длительное применение онкопрофилактических средств в постиниционный период не позволяет добиться полного 100%-ного торможения канцерогенеза, хотя снижение частоты и/или множественности может достигать 60%, но чаще около 30% (при статистической достоверности).
- Способность к ингибированию канцерогенеза даже известных онкопрофилактических средств (ретинол, ?-токоферол, 13-цис-ретиноевая кислота, ?-дифторметилорнитин и др.) не всегда подтверждалась, поэтому для гарантированного выявления активности у новых веществ необходимо проводить тестирование на нескольких моделях (не менее трех).
- Проявление онкопрофилактических свойств не является уникальным для какой-то определенной группы препаратов; отчетливая активность может быть выявлена у довольно широкого ряда синтетических и природных веществ с различным механизмом действия.
- В целом, комплексные природные вещества не уступают синтетическим соединениям по антиканцерогенной эффективности. В то же время, преимуществом природных веществ является их потенциально более низкая токсичность.
- У ряда веществ антиканцерогенная активность сочетается с другими позитивными фармакологическими эффектами: антиатеросклеротическим, адаптогенным, иммуномодулирующим, противовоспалительным, антиоксидантным и др.
- У комбинаций антиканцерогенных агентов выраженность и спектр антиканцерогенного действия может быть выше, а токсические эффекты менее выражены по сравнению с отдельными компонентами.
В результате экспериментов были отобраны и предложены для дальнейшего клинического изучения наиболее эффективные и безопасные антиканцерогенные вещества. Разработан алгоритм клинических исследований химиопрофилактических препаратов у пациентов из групп повышенного риска рака молочной железы, желудка, легких, толстой кишки с использованием клинических, эндоскопических, гормональных, биохимических, иммунологических, эхографических, рентгенологических, гистологических, цитологических, цитоморфометрических исследований и оценкой влияния на промежуточные биомаркеры повышенного онкологического риска. В проведенных клинических испытаниях выявлены химиопрофилактические средства, оказывающие выраженное лечебное действие на патологические сдвиги у пациентов из групп повышенного онкологического риска. Кламин (БАД на основе концентрата ламинарии) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию кишечной метаплазии и дисплазии у больных атрофическим гастритом; улучшал клинико-рентгенологическую картину, вызывал регрессию дисплазии и метаплазии эпителия бронхов у больных хроническим бронхитом курильщика; вызывал регрессию предраковых очагов у больных красным плоским лишаем ротовой полости; нормализовал стул, подавлял повышенную пролиферацию эпителия слизистой оболочки и вызывал частичную регрессия полипов у пациентов с аденоматозными полипами толстой кишки. Лесмин (БАД на основе хвойного комплекса) ослаблял симптомы диспепсии и эндоскопические признаки гастрита, подавлял инфекцию Helicobacter pylori, увеличивал уровень пепсиногена-пепсина в желудочном соке, вызывал регрессию лимфоплазмоцитарной инфильтрации и кишечной метаплазии слизистой оболочки желудка у больных атрофическим гастритом. Результаты доклинического и клинического изучения пищевых веществ и разработанных в лаборатории на их основе БАД опубликованы в нескольких монографиях (в частности: Беспалов В.Г. Питание и профилактика онкологических заболеваний. – Великий Новгород, Полиграфическая компания «Позитив», 2015. – 242 с.).
На основе концентрата ламинарии в качестве фармацевтической субстанции был создан и внедрен в клиническую практику лекарственный препарат мамоклам, который применяется для лечения фиброзно-кистозной болезни молочных желез. В проведенных клинических испытаниях установлено, что мамоклам значительно уменьшает проявления масталгии, предменструального напряжения молочных желез и альгоменореи, ослабляет пальпаторные признаки фиброзно-кистозной болезни, нормализует менструальный цикл, баланс тиреоидных и половых гормонов; по данным маммографии и эхографии вызывает регрессию фиброаденоматозных уплотнений и кист в ткани молочных желез, приводит к уменьшению диаметра расширенных млечных протоков, снижает маммографическую плотность. Результаты клинического изучения мамоклама обобщены в монографии: Беспалов В.Г. Мастопатия и лекарственный препарат мамоклам. Методическое пособие для врачей. – СПб.: Издательство «Игра света», 2008. – 68 с.
Доклиническое и клиническое изучение противоопухолевой активности фармакологических веществ и препаратов
В последние годы нами были пересмотрены результаты изучения ранее синтезированных противоопухолевых препаратов, чтобы выявить наиболее перспективные для внедрения в клиническую практику после более углубленного и широкого экспериментального исследования. Наибольший интерес привлекли два препарата: диоксадэт и хлонизол.
Диоксадэт относится к группе алкилирующих соединений – этилениминов. В лаборатории были разработаны новая схема синтеза фармацевтической субстанции и новая лекарственная лиофилизированная форма препарата, которые обеспечивают большую безопасность в производстве; разработан новый проект ФСП на лекарственную форму; проведены доклинические исследования по оценке противоопухолевой активности диоксадэта на стандартных моделях трансплантированных опухолей в сравнении с цитостатиками, применяемыми в клинической практике.
В доклинических исследованиях была установлена выраженная противоопухолевая активность диоксадэта на широком спектре перевиваемых опухолей у лабораторных животных. Данные сравнительного изучения диоксадэта свидетельствуют о его более высокой противоопухолевой активности, чем у наиболее близкого к нему по структуре тиофосфамида. В эксперименте на крысах с перевиваемой асцитной опухолью яичника противоопухолевое действие диоксадэта при внутрибрюшинном введении сравнимо с действием цисплатина, являющегося стандартом в клинической интраперитонеальной химиотерапии рака яичника. С учетом того, что диоксадэт, в отличие от препаратов платины, обладает значительно более низкой токсичностью, не вызывает осложнений в виде спаечного процесса, перспективным является применение диоксадэта для интраперитонеальной химиотерапии рака яичника. В экспериментах с асцитной опухолью Эрлиха у мышей выявлен выраженный синергизм противоопухолевого действия диоксадэта в комбинации с гемцитабином при отсутствии повышения токсичности.
Клинические испытания диоксадэта по II фазе были проведены в 15 онкологических учреждениях у 229 больных распространенными формами злокачественных новообразований различных локализаций. Несмотря на то, что все больные были с далеко зашедшими формами злокачественных новообразований, практически при всех локализациях был доказан объективный противоопухолевый эффект диоксадэта. Особенно сильным противоопухолевый эффект диоксадэта оказался в лечении распространенных форм рака яичников и молочной железы, в том числе у больных с асцитом и ранее леченных другими алкилирующими агентами. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации при операбельных и распространенных формах рака почки. Химиоэмболизация с диоксадэтом повышала 2- и 3-летнюю выживаемость больных неоперабельным раком почки. Были проведены клинические испытания диоксадэта в качестве противоопухолевого средства для химиоэмболизации печеночной артерии у больных с первичным раком печени и метастазами в печень колоректального рака. Была доказана эффективность химиоэмболизации с диоксадэтом в виде получения объективного противоопухолевого ответа и увеличения выживаемости больных.
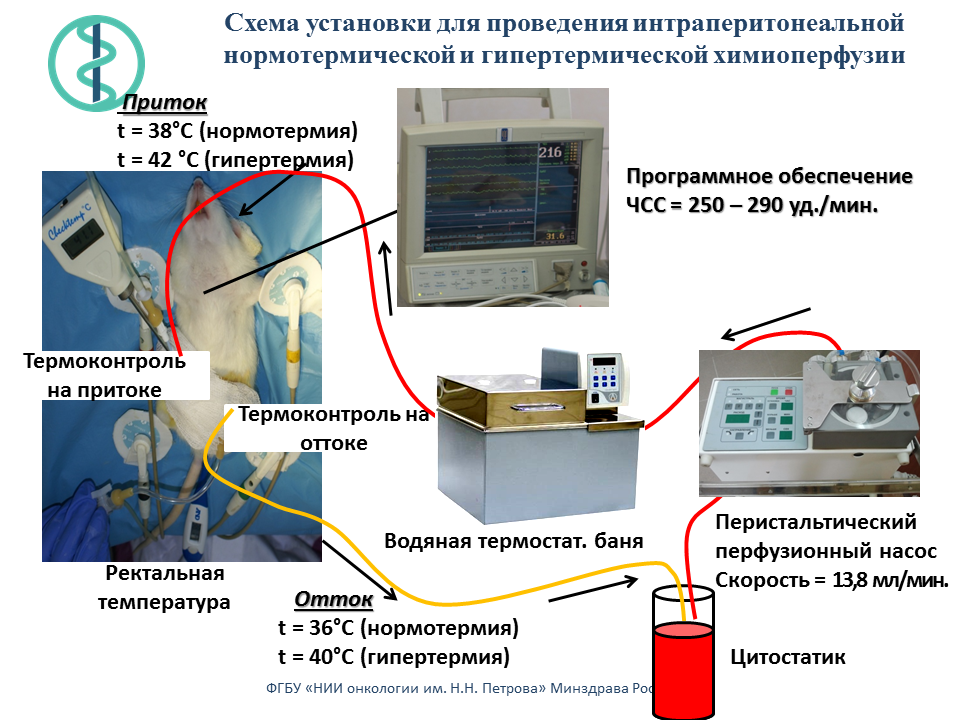
Диосадэт обладает выраженным так называемым контактным противопухолевым действием. В настоящее время в лаборатории развивается направление использования диоксадэта в различных режимах интраперитонеальной химиотерапии канцероматоза брюшной полости. Доклинические исследования показали, что диоксадэт при интраперитонеальной химиотерапии превосходит по эффективности и безопасности другие применяемые с этой целью цитостатики: циспалатин, паклитаксел, митомицин С, мелфалан.
Создана экспериментальная установка для химиоперфузионного лечения канцероматоза брюшной полости на моделях у крупных и мелких лабораторных животных.
Результаты доклинического и клинического изучения химиоперфузионного лечения злокачественных опухолей обобщены в монографии: Беляева О. А., Беспалов В. Г., Сенчик К. Ю., Киреева Г. С., СтуковА. Н., Гафтон Г. И., Карачун А. М., Гусейнов К. Д. Беляев А. М. Химиоперфузионное лечение канцероматоза брюшной полости. – СПб., 2016. – 146 с.
Проведено сравнительное статистическое исследование результатов восьми независимых экспериментов по изучению эффективности интраперитонеальной химиотерапии. Изучены режимы инъекционной внутрибрюшинной (в/б) химиотерапии (ИВХ), нормо– и гипертермической химиоперфузии (НИПХ и ГИПХ) препаратом диоксадэт на модели перевиваемого асцитного рака яичника (РЯ) у 288 крыс самок Вистар. Перевивка РЯ осуществляли в/б в количестве 1?107 опухолевых клеток, интраперитонеальную химиотерапию проводили однократно через 48 часов после трансплантации опухоли. Диоксадэт вводили в максимально переносимых дозах в/б: при ИВХ с помощью шприца в дозе 1,5 мг/кг массы тела; при НИПХ и ГИПХ раствор с цитостатиком прокачивали через брюшную полость специальным насосом соответственно в дозе 30 мг/кг при температуре 36,5–37,5°С и 15 мг/кг при температуре 40,5–41,5°С. В контрольных группах крысам в/б аналогичными путями вводили физиологический раствор. Противоопухолевые эффекты лечения оценивали по увеличению средней продолжительности жизни крыс. Для статистического анализа использован принцип гармонизации статистических доказательств и предсказаний. В контрольной группе с инъекционным в/б введением физиологического раствора средняя продолжительность жизни составила 15 дней, 95% доверительный интервал (ДИ) от 12 до 19. По сравнению с данным контролем воздействие ИВХ, НИПХ и ГИПХ увеличивало среднюю продолжительность жизни соответственно на 85, 97 и 202% (p
Источник