- Ротарод
- Тест ротарод для мышей и крыс
- Мы являемся официальным представителем IITC Life Science Inc. в России
- Тест производительности Rotarod — Rotarod performance test
- Обоснование
- Научное использование
- Аппаратно-программный комплекс «Ротарод»
- Технические характеристики
- Методические подходы к оценке паралитического синдрома токсического генеза в экспериментах на грызунах
- Резюме
- Введение
- Материал и методы
- Заключение
- Вклад авторов
Ротарод
Комплекс предназначен для определения двигательно-координационных нарушений по способности мелких лабораторных животных (крыс и мышей) удерживаться на вращающемся барабане.
АПК позволяет:
- Регистрировать:
- Двигательные нарушения
- Выносливость
- Состояние мотивации
- Дозировать физическую нагрузку
В основе методики положена способность мелких лабораторных животных (крысы и мыши) удерживаться на вращающемся барабане. Двигательный дефицит измеряется временем удержания. Комплекс позволяет одновременно проводить тестирование до 7 мышей или 4 крыс. Регистрация удержания и падения производится с помощью инфракрасных сенсоров.
Состояние мотивации исследуется путем изменения качества мотивационного стимула:
- Избегание болевых раздражений ударами электротока
- Боязнь высоты (необходим стол)
- Водная среда (необходим стол)
Для выработки стимуляции используется электрическая сетка, расположенная под движущимся барабаном
Наряду с простотой использования АПК предусмотрено большое количество изменяемых параметров, что удовлетворит потребности исследователей в самых разнообразных областях нормальной и патологической физиологии, фармакологии, кинезиологии, нейронауках.
Определяются и записываются следующие показатели
- Определение нахождения животного в отсеке барабана
- Длительность нахождения животного на барабане
- Пройденный животным путь
- Скорость вращения барабана в момент падения и посадки животного
- Характер мотивационного стимула (отсутствие/высота/водная среда/сетка электрокожного раздражения)
Настраиваются следующие параметры
- В реальном времени может изменяться скорость вращения барабана
- Вращение барабана возможно задавать сценарием
- Изменение характера мотивационного стимула (отсутствие/высота/водная среда/сетка электрокожного раздражения)
- В широких пределах задается характер электростимуляции
АПК создан по требованиям безопасности медицинского оборудования
- Все компоненты изготовлены из нетоксичных, стойких к загрязнению материалов
- Наличие гальванической развязки питания
- Возможность экстренной остановки вращения барабана и подачи электротока на сетку
Линейные размеры аппарата в собранном состоянии (ШхВхГ)
Материалы оргстекло, алюминий
Барабан для крыс 4 отсека (5×70 и 5×90 мм)
- внутренний диаметр 70 мм
- внешний диаметр 370 мм
Барабан для мышей 7 отсеков (5×40 и 5×60 мм)
- внутренний диаметр 40 мм
- внешний диаметр 370 мм
Детекция грызунов — Автоматическая в инфракрасном диапазоне (появление и падение)
- Отсутствие
- Электрокожное раздражение
- Боязнь высоты
- Боязнь воды
Соединение с компьютером — USB
Шаг электрической сетки 18 мм
Диаметр прутьев электрической сетки 3 мм
Переключение полярности по прутьям 10 Гц, 8 фаз
Минимальная длительность электрического импульса 50 мс
Максимальная сила тока электросетки 15 мА
Максимальное напряжение электросетки 100 В
Питание от сети 220 В
Высота падения (при наличии специального стола) — 800 мм
Комплектации и цены
Стандартная комплектация — 260 000 Р
- АПК Ротарод, 1 барабан (для мышей или крыс), электрическая сетка
Стол с отверстием под Ротарод (высотой 100 см, на колесах) и ящик для сбора упавших животных — 50 000 Р
Требования к компьютеру Windows 10/Ubuntu 16.
Источник
 Тест ротарод для мышей и крыс
Тест ротарод для мышей и крыс 
Вы можете ознакомиться с характеристиками и купить товар «Ротарод для мышей и крыс» по выгодной цене, которую следует уточнить, сделав запрос.
Мы являемся официальным представителем IITC Life Science Inc. в России
Вам также доступны следующие материалы:
Тест ротарод используется для оценки действия лекарств на моторную координацию или сопротивляемость усталости у мышей и крыс. Для тестирования применяется одно устройство, а сама процедура безопасна и гуманна. Животные помещаются на вращающиеся барабаны с текстурированной поверхностью, чтобы избежать соскальзывания. Когда животное падает вниз на индивидуальную сенсорную платформу, результаты теста сохраняются и выводятся на переднюю панель устройства.
Одновременно можно тестировать 5 крыс или мышей на соседних дорожках.
Для экспериментов с мышами используются барабаны диаметром 1? дюйма, а с крысами — 3? дюйма. Для того, чтобы поменять барабаны требуется простая отвертка.
На ЖК-экране отображаются результаты тестов: скорость вращения в момент окончания теста, продолжительность теста и пройденное расстояние.
Падение животных на сенсорную панель улавливается магнитными переключателями, которые не требуют настройки в отличие от имеющихся на рынке аналогов с фотоэлектронными сенсорами. Вертикальные акриловые панели препятствуют побегу животных.
Прибор имеет электронную начинку. Все параметры эксперимента задаются цифровым методом с использованием клавиатуры, встроенной в переднюю панель. На передней панели также имеются кнопки: старт, стоп и сброс. Все вводимые параметры и результаты тестов отображаются на встроенном ЖК-экране.
Источник
Тест производительности Rotarod — Rotarod performance test
Тест производительности Rotarod является тестом производительности на основе вращающегося стержня с принудительной двигательной активностью применяется, как правило , с помощью грызуна . Тест измеряет такие параметры, как время езды (в секундах) или выносливость . Некоторые из функций теста включают оценку баланса, силы захвата и координации движений испытуемых; особенно при проверке действия экспериментальных препаратов или после черепно-мозговой травмы .
Обоснование
В ходе испытания грызуна помещают на горизонтально ориентированный вращающийся цилиндр (стержень), подвешенный над полом клетки, который находится достаточно низко, чтобы не травмировать животное, но достаточно высоко, чтобы избежать падения. Грызуны, естественно, стараются оставаться на вращающемся цилиндре или вращающемся стержне и не упасть на землю. Время, в течение которого данное животное остается на этом вращающемся стержне, является мерой его баланса , координации , физического состояния и двигательного планирования . Скорость вращающегося стержня приводится в движение механически и может поддерживаться постоянной или увеличиваться.
Человеческий аналог теста с вращающимся стержнем может быть беговой дорожкой. Владельцы хомяков , песчанок и мышей могут наблюдать принцип в действии, когда животное лезет на внешнюю сторону своего колеса , а не внутри него. Однако в испытании с вращающимся стержнем вращение цилиндра в экспериментах осуществляется механически.
Научное использование
Преимущество этого теста заключается в том, что он создает дискретно измеряемую непрерывную переменную (продолжительность времени), которую можно использовать в статистических целях для количественной оценки эффектов различных лекарств, состояний и процедур. В этом тесте не используются субъективные оценки способностей, и надежность между экспертами будет практически идеальной. Межлабораторная надежность будет достигнута только в том случае, если различные параметры (размер цилиндра, скорость цилиндра, состав материала поверхности и объем практики / обучения животного) также будут воспроизведены. Эксперимент также можно воспроизвести из лаборатории в лабораторию (там же). Более того, эти параметры можно регулировать по-разному, чтобы оптимизировать статистическое разделение различных условий. Например, воздействие алкоголя на мышей становится менее очевидным при увеличении скорости.
Из-за опасений по поводу ухудшения моторного поведения человека в результате использования рецептурных лекарств тест с вращающимся стержнем часто используется на ранних стадиях разработки лекарств для выявления лекарств, которые впоследствии могут вызвать легкие нарушения, которые могут не обнаруживаться эпидемиологически в человеческой популяции. очень долгое время. Тест может быть полезен как чувствительный индикатор травмы, вызванной повреждением головного мозга у лабораторных крыс . Алкоголь заметно ухудшает производительность мыши в тесте с вращающимся стержнем. Исследования с использованием теста вращающегося стержня с различными химическими агонистами и антагонистами могут помочь ученым определить, какие компоненты нейронов опосредуют действие химических веществ. Тестирование животных с генетическим нокаутом может помочь определить гены, наиболее ответственные за поддержание баланса и координации у млекопитающих. Сравнение производительности различных животных с конкретными поражениями головного мозга помогает ученым определить, какие структуры имеют решающее значение для поддержания баланса.
Источник
Аппаратно-программный комплекс «Ротарод»
Комплекс предназначен для определения двигательно-координационных нарушений по способности мелких лабораторных животных (крыс и мышей) удерживаться на вращающемся барабане.
АПК позволяет:
- Регистрировать:
- Двигательные нарушения
- Выносливость
- Состояние мотивации
- Дозировать физическую нагрузку
В основе методики положена способность мелких лабораторных животных (крысы и мыши) удерживаться на вращающемся барабане. Двигательный дефицит измеряется временем удержания. Комплекс позволяет одновременно проводить тестирование до 7 мышей или 4 крыс. Регистрация удержания и падения производится с помощью инфракрасных сенсоров.
Состояние мотивации исследуется путем изменения качества мотивационного стимула:
- Избегание болевых раздражений ударами электротока
- Боязнь высоты (необходим стол)
- Водная среда (необходим стол)
Для выработки стимуляции используется электрическая сетка, расположенная под движущимся барабаном.
Наряду с простотой использования АПК предусмотрено большое количество изменяемых параметров, что удовлетворит потребности исследователей в самых разнообразных областях нормальной и патологической физиологии, фармакологии, кинезиологии, нейронауках.
Технические характеристики
| Линейные размеры (ШхГхВ) | 506 x 476 x 300 мм | |
| Материалы | Оргстекло, алюминий, нержавеющая сталь | |
| Барабан | для крыс | 4 отсека (3×70 и 1×90 мм) внутренний диаметр 69 мм внешний диаметр 370 мм |
| для мышей | 7 отсеков (6×40 и 1×55 мм) внутренний диаметр 40 мм внешний диаметр 370 мм | |
| Детекция грызунов | Автоматическая, в инфракрасном диапазоне (появление и падение) | |
| Мотивационные стимулы | Отсутствие Электрокожное раздражение Боязнь высоты Боязнь воды | |
| Соединение с компьютером | USB | |
| Шаг электрической сетки | 18 мм | |
| Диаметр прутьев электрической сетки | 3 мм | |
| Напряжение электросетки | 100 В | |
| Cила тока электросетки | до 15 мА | |
| Принцип действия | 8 фаз, 2.5 Гц, импульсы по 50 мс Как это работает | |
| Питание от сети | 220 В | |
| Высота падения (при наличии специального стола) | 770 мм | |
| Требования к компьютеру | Windows 10/Ubuntu 18.0+ | |
| Гарантия | 1 год | |
| Производство | Россия, ООО «Нейроботикс» | |
- Определяются и записываются следующие показатели:
- Определение нахождения животного в отсеке барабана
- Длительность нахождения животного на барабане
- Пройденный животным путь
- Скорость вращения барабана в момент падения и посадки животного
- Характер мотивационного стимула (отсутствие/высота/водная среда/сетка электрокожного раздражения)
- Настраиваются следующие параметры:
- В реальном времени может изменяться скорость вращения барабана
- Вращение барабана возможно задавать сценарием
- Изменение характера мотивационного стимула (отсутствие/высота/водная среда/сетка электрокожного раздражения)
- Сила тока электростимуляции
АПК создан по требованиям безопасности медицинского оборудования:
- Все компоненты изготовлены из нетоксичных, стойких к загрязнению материалов
- Наличие гальванической развязки питания
- Возможность экстренной остановки вращения барабана и подачи электротока на сетку
Источник
Методические подходы к оценке паралитического синдрома токсического генеза в экспериментах на грызунах
Н.С. Ильинский, заместитель начальника отдела ФГБУ «ГНИИИ ВМ» МО РФ. ORCID: 0000-0001-7406-753X
М.А. Тюнин, начальник отдела ФГБУ «ГНИИИ ВМ» МО РФ, к.м.н., ORCID: 0000-0002-6974-5583
М.О. Матросова, младший научный сотрудник ФГБУ «ГНИИИ ВМ» МО РФ. ORCID: 0000-0002-1395-823X
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
195043, Санкт-Петербург, ул. Лесопарковая, д. 4
Резюме
Требования фармакологической безопасности предписывают необходимость выполнения экспериментальной оценки потенциальных нейротоксичных эффектов разрабатываемых лекарственных средств. При этом сохранена необходимость экспериментального моделирования заболеваний периферической нервной системы для изучения их патогенеза и разработки новых подходов к терапии. В настоящее время внедрен в практику широкий перечень клинико-функциональных тестов, позволяющих выявить многие виды неврологического дефицита. Однако сохраняются некоторые терминологические и методологические разночтения между клинической и экспериментальной практикой. Все это обусловливает высокую актуальность исследований по совершенствованию методов оценки нейротоксических эффектов ксенобиотиков в экспериментах на лабораторных грызунах.
Цель – сравнить информативность исследования физиологического двигательного рефлекса у крыс при помощи шкалы отведения пальцев с другими рекомендованными методиками оценки периферического пареза.
Проведено комплексное клинико-инструментальное исследование по динамической оценке неврологического статуса самцов беспородных крыс на модели токсического тетрапареза, вызванного подкожным введением ЛД16 тетродотоксина. Введение тетродотоксина способно стабильно и с высокой повторяемостью вызывать у подопытных животных своеобразный синдром моторного дефицита (периферический парез) за счет неврального и мышечного компонентов. Внешние проявления интоксикации у крыс оценивали с помощью теста подтягивания на перекладине, «Ротарод» и шкалы отведения пальцев. С целью верификации нарушений процессов неврального проведения и нервно-мышечной передачи животным выполняли электронейромиографию и декремент-тест.
Результаты исследования продемонстрировали, что общепринятый в настоящее время методический аппарат экспериментальной оценки неврологического статуса способен выявить нарушения двигательных функций у крыс при достаточной их выраженности, когда по данным нейрофизиологического исследования уже наличествуют грубые изменения основных параметров. В ходе сравнения скорости возникновения и выраженности внешних признаков интоксикации установлено, что оценка физиологического двигательного рефлекса при помощи шкалы отведения пальцев обладает достаточно высокой информативностью и простотой тестирования, делая возможным выявление ранних признаков периферического пареза токсического генеза.
Введение
Вопросы стандартизации и повышения качества исследований безопасности химических соединений, особенно в отношении нейротоксичности, в экспериментах на животных представляют актуальную задачу, в том числе по причине методических разночтений. На сегодняшний день сохранена проблема неоднозначных подходов к терминологии, способам оценки и трактовке результатов исследований параличей (парезов) токсического генеза, при этом их скрининговая доклиническая оценка на грызунах представляет собой необходимый минимум, что подтверждено наличием многочисленных вариаций батарей клинико-функциональных тестов (КФТ) [1]. В соответствии с принятой в неврологии терминологией [2] расстройство двигательной функции в виде полного отсутствия произвольных движений вследствие нарушения иннервации соответствующих мышц называют параличом. При частичном нарушении двигательной функции говорят о парезе. Для периферических параличей (парезов) характерно сочетание следующих признаков: снижение объема активных движений и/или мышечной силы; снижение мышечного тонуса, физиологических рефлексов, замыкающихся на этих мышцах; атрофия или гипотрофия паретичных мышц; фасцикуляции (или фибрилляции) пораженных мышц [2]. Следовательно, для одновременной оценки всех вышеописанных симптомов необходимо применять комплекс соответствующих диагностических приемов. Методический аппарат по исследованию мышечной силы у мелких лабораторных животных наиболее разнообразен и популярен среди иностранных и отечественных ученых. Широко применяют методики подтягивания на горизонтальной перекладине, удерживания на решетке, измерение силы захвата с использованием специализированных приборов [1]. Несколько несоответствующими цели, однако, общепринятыми и традиционными способами оценки состояния мышечного тонуса (или миорелаксантного эффекта) в экспериментах являются методы вращающегося стержня («Ротарод»), бега на третбане, ипсилатеральный сгибательный рефлекс. Наиболее близкая к клинической практике методика пальпаторного исследования тонуса мышц живота у крыс выглядит излишне субъективной и трудно ранжируемой [2].
Вместе с тем в отечественной литературе представлено недостаточно методик исследования состояния двигательных рефлексов у грызунов как признаков периферического пареза. В связи с этим проведено сравнительное динамическое исследование информативности различных способов оценки двигательных функций крыс в эксперименте на модели острого тяжелого отравления блокатором натриевых каналов. Выбор тетродотоксина (ТТ) в качестве модельного токсиканта обусловлен особенностями его механизма действия, определяемыми наличием точек приложения на протяжении аксонов смешанных периферических нервов и на сарколемме поперечнополосатых миоцитов, что позволяет в течение короткого времени стабильно и с высокой повторяемостью вызывать у подопытных животных своеобразный синдром моторного дефицита (периферический парез) за счет неврального и мышечного компонентов.
Цель исследования – сравнить информативность исследования физиологического двигательного рефлекса у крыс при помощи шкалы отведения пальцев (ШОП) с другими рекомендованными методиками оценки периферического пареза.
Материал и методы
Эксперименты выполнены с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), в соответствии с правилами надлежащей лабораторной практики и директивой 2010/63/EU Европейского парламента и совета Европейского Союза от 22 сентября 2010 г. по охране животных, используемых в научных целях.
Исследование проведено на 40 самцах беспородных крыс (питомник ФГУП «ПЛЖ «Рапполово», Ленинградская обл., Россия). Животных содержали в стандартных условиях окружающей среды (фоторежим 12 ч свет/12 ч темнота, температура воздуха 22±3°С, влажность 55±10%). В качестве корма использовали «Корм для содержания лабораторных животных» ЛБК-120, приготовленный в соответствии с ГОСТом Р 50258-92. Воду в стандартных поилках со стальными крышками-носиками давали ad libitum. В качестве подстила использовали древесные опилки из лиственных пород деревьев. После завершения эксперимента животных подвергали эвтаназии в СО2-камере.
Периферический парез токсической природы моделировали путем подкожного введения раствора ТТ (CAS № 4368-28-9, Sigma Aldrich, Германия) в дозе ЛД16 (8,5 мкг/кг). В качестве растворителя использовали цитратный буфер (рН 4,5). Исследования выполняли в двух равных группах животных. Весь объем обследования животных проводили с периодичностью в 2 мин в течение первых 30 мин после введения ТТ.
Первую группу (n=20) оценивали с помощью КФТ (ШОП, «Ротарод», ООО «Нейроботикс», Россия), подтягивание на горизонтальной перекладине). Оценку по ШОП выполняли в соответствии с методикой R.S. Broide и соавт. [3] в собственной модификации. Оценивали выраженность рефлекторного разведения пальцев стоп при поднятии крысы за хвост на высоту 20 см над поверхностью и имитации падения. В норме крыса готовится к приземлению и широко расставляет грудные и тазовые конечности, разводя при этом пальцы. Здоровое животное способно удерживать такое положение достаточно длительно (>10 с), что соответствовало 0 баллов ШОП. На фоне токсического пареза выраженность данного рефлекса снижалась: первоначально крыса расставляла пальцы на несколько секунд, затем 1 или 2 пальца стопы оказывались прижатыми друг к другу – 1 балл, 3 пальца – 2 балла, 4 пальца – 3 балла, все 5 пальцев или полное отсутствие попытки разведения пальцев – 4 балла. Методику «Ротарод» (ООО «Нейроботикс», Россия) выполняли, измеряя время (с), в течение которого крыса способна передвигаться по вращающемуся со скоростью 5 об/мин стержню (в норме >120 с) [1]. Тест подтягивания на горизонтальной перекладине («перекладина») оценивали по способности крыс подтянуться из положения виса на передних конечностях и зацепиться нижней конечностью за перекладину в течение 20 с. Тест считался не выполненным (отрицательным), если животному требовалось больше времени или оно вовсе не удерживалось на перекладине [1].
С целью объективизации нарушений нервно-мышечного проведения и передачи второй группе крыс (n=20) выполняли электронейромиографию (ЭНМГ) икроножной мышцы (n. tibialis) правой тазовой конечности по методике, описанной ранее [4]. При одиночной стимуляции оценивали следующие параметры М-ответа: амплитуда, длительность, площадь, дистальная латентность. При ритмической стимуляции фиксировали характер и степень выраженности декремента площади М-ответов. Сравнение показателей проводили с данными, полученными заблаговременно до индукции отравления (фоновые значения). ЭНМГ-феномены количественно характеризовали степень снижения амплитуды последнего М-ответа относительно первого. При выявлении инкремента выполняли анализ по площади негативного пика для исключения псевдофасилитации. Колебания площади М-ответов в пределах 10% принимали за норму.
Связанные выборки сравнивали с помощью непараметрического критерия знаковых рангов Уилкоксона; бинарные данные определяли, используя точный критерий Фишера. Результаты представляли в виде медианы и межквартильного интервала. Для статистической обработки данных использовали пакет прикладных программ Statistica 10.0 (StatSoft, США) в операционной среде Windows 7. За номинальный уровень статистической значимости принимали значение р течение следующих 10 мин наблюдения.
ЭНМГ-исследование позволило выявить ТТ-индуцированное страдание функций периферической нервной системы в виде статистически значимых изменений основных параметров неврального проведения раньше, чем любой из КФТ. Так, длительность М-ответов увеличилась (р=0,04) уже через 6 мин после введения ТТ, амплитуда уменьшилась (р=0,01) через 10 мин, латентность увеличилась (р=0,03) через 15 мин. Нарастание декремента площади М-ответов как признак снижения надежности нервно-мышечной передачи достигло уровня статистической значимости через 8 мин.
Заключение
Результаты проведенного исследования позволяют заключить, что общепринятый в настоящее время методический аппарат экспериментальной оценки паралитического или миорелаксантного действия ксенобиотиков с помощью КФТ способен выявить нарушения нервно-мышечного проведения и передачи при достаточной их выраженности, когда по данным ЭНМГ уже наличествуют грубые изменения основных параметров. При этом рассмотренная адаптированная методика ШОП позволила обнаружить наиболее ранние признаки периферического пареза, что было хронологически сопоставимо с данными ЭНМГ. Оценка физиологического двигательного рефлекса у крыс при помощи ШОП обладает достаточно высокой информативностью и простотой тестирования, делая возможным выявление ранних признаков периферического пареза на фоне отравления ТТ. С целью дальнейшей валидации искомой методики целесообразно проводить эксперименты с применением нейротоксичных ксенобиотиков других химических групп и механизмов действия, а также изучить зависимость баллов по ШОП с дозами выбранных токсикантов.
Вклад авторов
Н.С. Ильинский – концепция, сбор и анализ данных, написание текста статьи.
М.А. Тюнин – научное консультирование, утверждение окончательного варианта статьи для публикации.
М.О. Матросова – сбор и анализ данных.
Источник

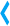 Тест ротарод для мышей и крыс
Тест ротарод для мышей и крыс