Метод прижизненной диагностики цилиарной активности многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа у лабораторных крыс
С.В. Барашкова(1,3), младший научный сотрудник, С.Г. Журавский(2,3), доктор медицинских наук, руководитель группы экспериментальной патоморфологии, С.И. Алексеенко(1,4), кандидат медицинских наук, доцент 1-Санкт-Петербургское государственное бюджетное учреждение здравоохранения «Детская городская больница имени К.А. Раухфуса», 191036, Россия, Санкт-Петербург, Лиговский пр-т, д. 8; 2-Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова» Министерства здравоохранения Российской Федерации, 197022, Россия, Санкт-Петербург, ул. Льва Толстого, д. 6-8; 3-Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр имени В.А. Алмазова» Министерства здравоохранения Российской Федерации, 197341, Россия, Санкт-Петербург, ул. Аккуратова, д. 2; 4-Федеральное государственное бюджетное образовательное учреждение высшего образования «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Министерства здравоохранения Российской Федерации, 191015, Россия, Санкт-Петербург, ул. Кирочная, д. 41 e-mail: patanatomdgb19@yandex.ru
Резюме
Представлены результаты сравнительного исследования прижизненного цитологического материала многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа интактных взрослых крыс самцов стока Wistar (220–250 г), содержащихся в вивариях конвенционального типа (n=2) и SPF-категории (n=2). Интактная картина клеток многорядного столбчатого реснитчатого эпителия отмечена в материале животных SPF-статуса. У животных конвенционального вивария наблюдали проявления подострого воспаления и персистирования бактериальной инфекции. При этом имели место морфофункциональные признаки дегенерации цилиарного аппарата: укорочение, асинхронизм и неполный цикл биения цилий. Наилучшее качество цитологического материала при браш-биопсии in vivo было получено при использовании комбинированных цервикальных щеток «Cervex-Brush Combi» из полимерного материала, модифицированных путем тримминга щетинок центрального ершика.
Введение
Экспериментальные исследования, связанные с морфофункциональным анализом состояния многорядного столбчатого реснитчатого эпителия верхних дыхательных путей нацелены на изучение влияния лекарственных препаратов и фармакологических аддитивов на цилиарную активность [1–3]. Традиционно для этого используют метод культивирования реснитчатого эпителия иссеченной перегородки носа, эпителия трахеальных колец или эпителия дистальных отделов дыхательных путей в тонких срезах легочной ткани, полученных от умерщвленных животных [1, 2, 4, 5]. Особенность метода – необходимость затратной материально-технической базы на культивирование эпителиальных клеток in vitro, зависящих от таких факторов, как температура, влажность, pH, вязкость и ионный состав инкубационной среды [3]. При этом отсутствует возможность оценивать функцию и морфологию мукоцилиарной системы в экспериментах in vivo, моделирующих клинические условия.
Разработка метода получения в хроническом эксперименте in vivo на повседневно использующихся биологических тест-системах (лабораторных грызунах) нативного материала многорядного столбчатого реснитчатого эпителия позволит проводить динамическое наблюдение при экспериментальной патологии, скрининг фармакологических субстанций по цилиоактивным свойствам. Актуальность нашего эксперимента обусловлена также появлением перспективного направления топического применения вакцин, аэрозольных препаратов для коррекции генетических заболеваний, лечения опухолей носоглотки и легких [6, 7].
Цель исследования – разработка метода для изучения цилиарной активности многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа in vivo у лабораторных крыс.
Материал и методы
В работе использованы 4 крысы – самцы стока Wistar массой 220–250 г, содержащиеся в условиях конвенционального вивария (n=2; ПЛЖ «Рапполово», Ленинградская область) и вивария SPF-категории (n=2; ПЛЖ «Пущино», Московская область). Процедура браш-биопсии проводилась неоднократно у животных, находящихся в условиях общей анестезии при интраперитонеальном введении препарата «Золетил 100» (6 мг/кг) и ингаляционном введении воздушной смеси с 2,5% содержанием изофлюрана. Для выполнения браш-биопсии применяли различного вида инструментарий, доступный на рынке медицинских средств. Цитологический материал слизистой оболочки носовой перегородки и нижней носовой раковины получали на глубине 1–1,5 см от кожной части преддверия носа, ориентируясь на проекцию резцового сосочка и первого небного гребня – в зоне наибольшего представительства на слизистой оболочке полости носа многорядного столбчатого реснитчатого эпителия [8, 9].
При проведении браш-биопсии сравнивали качество материала, полученного при использовании интрадентальных ершиков Curaprox prime 0,6–2,2 мм с держателем (Curaprox, Германия), цитологических щеток Cervex-Brush Combi (Rovers Medical Devices, Нидерланды), цитологических щеток для эндоскопов Olympus (Olympus, Япония) (рис. 1). Весь имевшийся инструментарий предварительно модифицировали следующим образом: нейлоновые щетинки интрадентальных ершиков и цитологических щеток для эндоскопов обстригали ножницами до их основания, у цитологической щетки Cervex-Brush Combi удаляли боковые щетинки, центральный ершик разделяли пополам с помощью микротомного лезвия, оставляя одну рабочую поверхность, покрытую ворсинками, укороченными с помощью ножниц до основания, апикальный край оплавляли на открытом пламени горелки в течение 1 с. Стерилизация перед процедурой проводилась в этиловом спирте 95° в течение 40 мин.
После взятия материала кончик щетки споласкивался в пробирке Эппендорф с 0,5 мл физиологического раствора (37°С). Полученную суспензию в объеме 50 мкл немедленно наносили на предметное стекло и накрывали покровным стеклом. Визуальный анализ нативного материала проводился на микроскопе Nikon Eclipse E200 с дополнительной комплектацией для фазового контраста с объективами CFI Achromat DL ×40 и CFI Achromat ×100 oil (Nikon, Япония). Для каждого образца в режиме реального времени записывался цифровой видеофайл с частотой в среднем 76,5 кадров в секунду с помощью высокоскоростной цветной камеры Basler puA2500-14uc USB3.0. Морфометрическая обработка видеороликов осуществлялась в программе MMC Multimeter (MMCSoft, Россия). Оставшийся материал наносился на предметные стекла с помощью цитоцентрифуги Cyto-Tek (Sakura, Япония) и окрашивался гематоксилином Гарриса по Папаниколау и эозином-метиленовым синим по Май-Грюнвальду Гимза.
Результаты и обсуждение
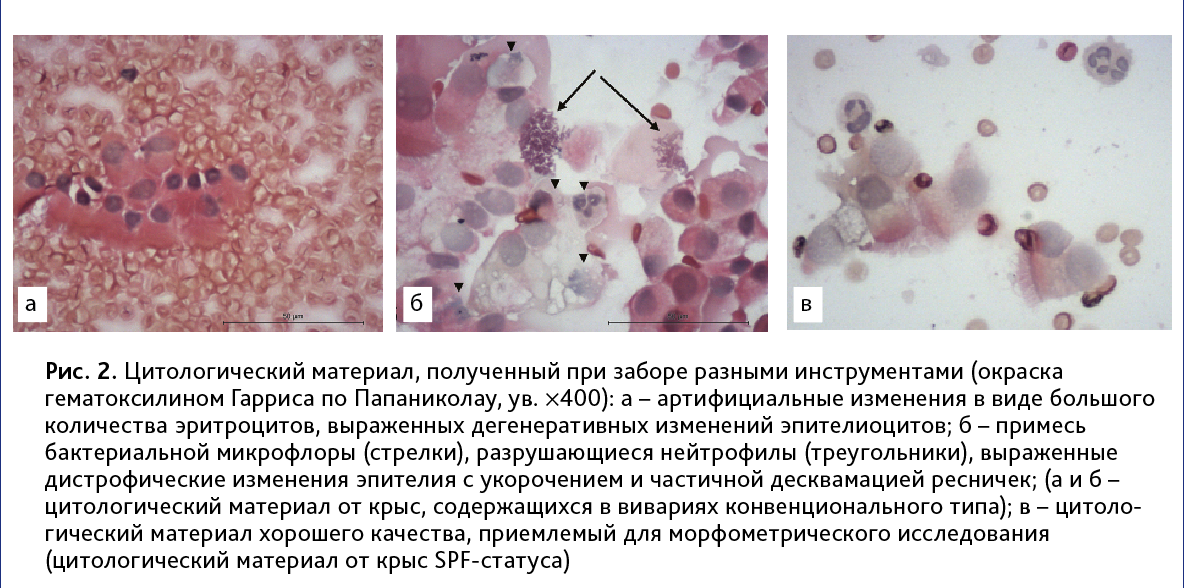
Выполнение биопсии с помощью нейлоновых ершиков и браш-щеток для эндоскопов очень травматично для слизистой оболочки полости носа. Полученный материал имел выраженные артифициальные изменения в виде большого количества эритроцитов, мешающих проведению видеорегистрации, а также клетки низкого качества в связи с их механической деструкцией и дегенерацией (рис. 2, а). Кроме того, длина рабочей поверхности использованных инструментов не позволяла без дополнительной травмирующей компрессии преддверия достигать необходимого уровня глубины полости носа.
Наилучшие результаты были получены с помощью полимерных комбинированных гинекологических щеток Cervex-Brush Combi (Rovers Medical Devices, Нидерланды) после их модифицирования для наименьшего травмирования слизистой оболочки путем тримминга щетинок центрального ершика (см. рис. 1). Таким инструментом у взрослой крысы удалось изъять достаточный объем цитологического материала при минимальном загрязнении эритроцитарной массой и хорошей сохранности пластов клеток многорядного реснитчатого эпителия (рис. 2, в).
Обратим внимание, что цитологический материал крыс, содержащихся в условиях конвенционального вивария, во всех случаях показывал высокую бактериальную обсемененность, наличие нейтрофильного экссудата, выраженные реактивно-дистрофические изменения многорядного респираторного эпителия с укорочением и повышенным слущиванием цилий (рис. 2, б). Эти изменения расценивались как признаки текущего подострого воспаления. Двигательная активность цилиарного аппарата была зарегистрирована лишь на минимальном количестве клеток с явлениями асинхронизма, неполного цикла биения цилий, что не позволяло провести полноценной морфометрической оценки.
В образцах, полученных у животных SPF-статуса, отсутствовала микрофлора и элементы воспалительного экссудата. При морфометрическом анализе выявлена неравномерная частота биения ресничек в различных пластах в пределах диапазона нормальных значений (7,94–13,87 Гц). Различий в качестве полученного цитологического материала (визуальное состояние клеток эпителия, двигательная активность цилиарного аппарата) при браш-биопсиях, проводимых в условиях газовой и интраперитонеальной анестезии, выявлено не было.
Таким образом, в результате проведенного исследования удалось убедиться в возможности прижизненного получения и исследования цитологического материала многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа крыс. Несомненное преимущество – использование животных SPF-статуса, что позволяет исключить влияние экзо- и эндогенных патологических факторов, влияющих на работу цилиарного аппарата многорядного реснитчатого эпителия (воспалительные процессы верхних дыхательных путей в условиях вирусных и бактериальных персистенций, воздействия кормовых, подстилочных поллютантов и пр.).
Предлагаемый метод позволяет неоднократно получать цитологический материал слизистой оболочки полости носа и проводить динамическое исследование на одной биологической тест-системе. Значительную экономическую выгоду составляет аспект масштабных скрининговых исследований по поиску цилиотропных препаратов на лимитированной группе экспериментальных животных, ограниченных только периодом естественного обновления реснитчатого эпителия верхних дыхательных путей.
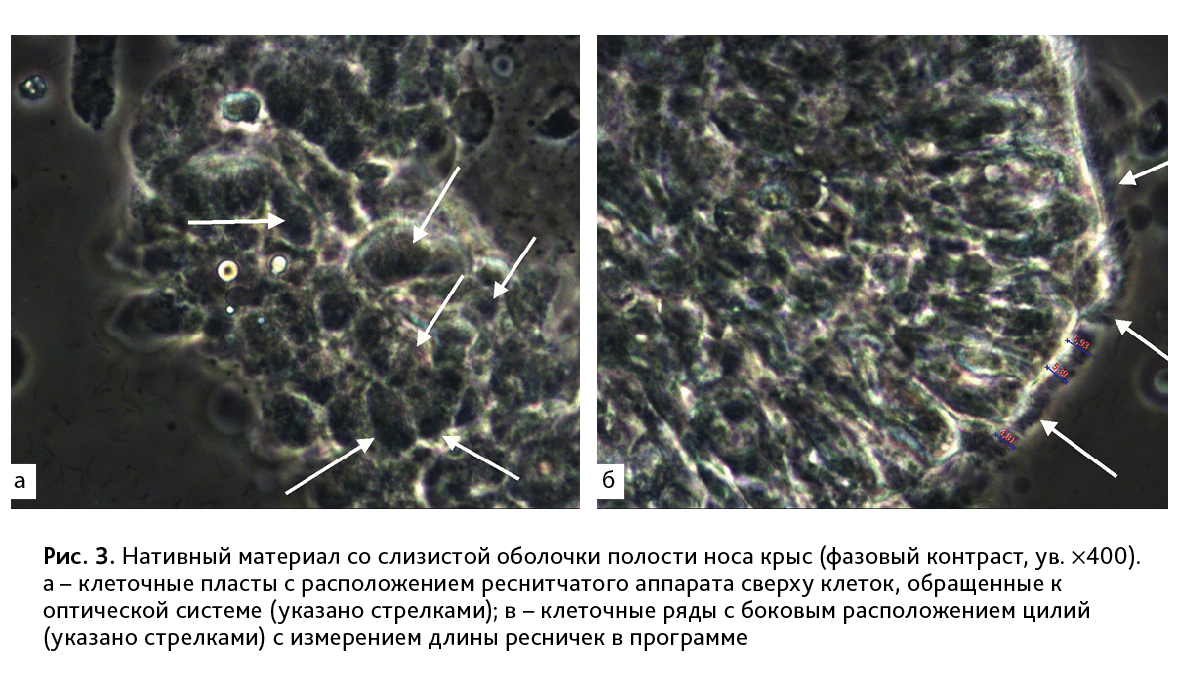
Следующим этапом методической разработки планируется решение проблемы с оптимальной пространственной ориентацией клеточных рядов для проведения морфометрии. На данный момент исследователь лишен возможности регулировать положение цилиарного аппарата в пространстве по отношению к оптической системе. В ходе браш-биопсии получаются обширные клеточные пласты или наслаивающиеся ряды клеток, что ограничивает возможности полноценного морфометрического исследования, требующего расположения цилий в сагиттальной плоскости («в профиль») (рис. 3). В перспективе предстоит разработать методическое обеспечение для атравматичной диссекции полученных эпителиальных пластов на однослойные ряды клеток в условиях in vitro и ориентации клеток в положение, оптимальное для анализа функционального состояния цилиарного аппарата, с возможностью более детального изучения состояния эпителиоцитов.
Интерес к разработке доступного метода прижизненной оценки цилиарной активности на крысах подкрепляется данными литературы, в которых морфологическая картина и морфометрические показатели многорядного столбчатого реснитчатого эпителия крыс наиболее соответствуют параметрам, полученным у человека [4, 10–12]. Кроме того, прижизненное изучение мукоцилиарной системы на таких грызунах как, лабораторные мыши, востребовано не менее, но подбор инструмента для малых размеров носовых ходов остается пока технически неразрешенной задачей.
Заключение
По результатам изложенного сделаны следующие выводы:
- Браш-биопсия слизистой оболочки носа у крыс – технически легко выполняемая, малоинвазивная и низкотравматичная процедура.
- Качество прижизненно полученного цитологического материала многорядного столбчатого реснитчатого эпителия слизистой оболочки полости носа в абсолютной степени зависит от условий разведения и содержания животных в виварии. Использование животных SPF-статуса становится ключевым условием для проведения исследований, связанных с изучением органов дыхательной системы.
- Бесспорное преимущество метода – возможность динамического исследования на одной биологической тест-системе.
Источник
Слизистая оболочка носа крыс
Вдыхаемый воздух для соприкосновения с нежной тканью легких должен быть очищен от пыли, согрет и увлажнен. Это достигается в полости носа, cavitas nasi; кроме того, различают наружный нос, nasus extemus, который имеет частью костный скелет, частью хрящевой.
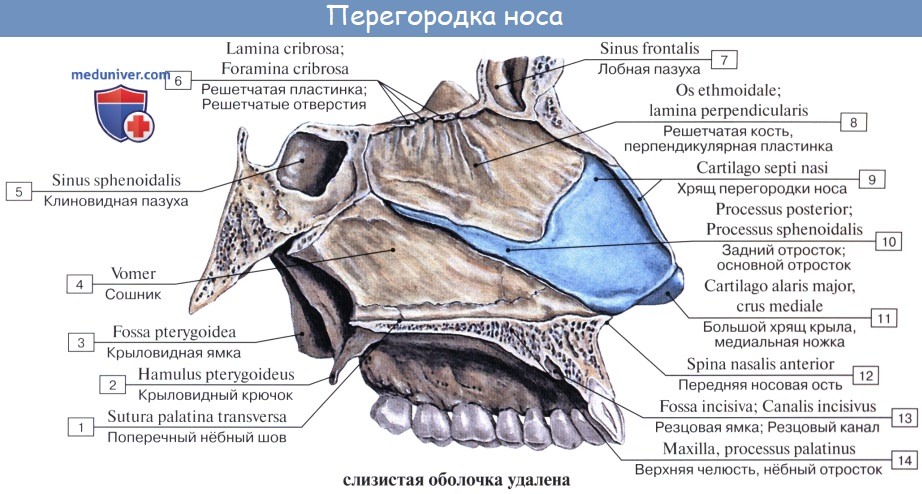
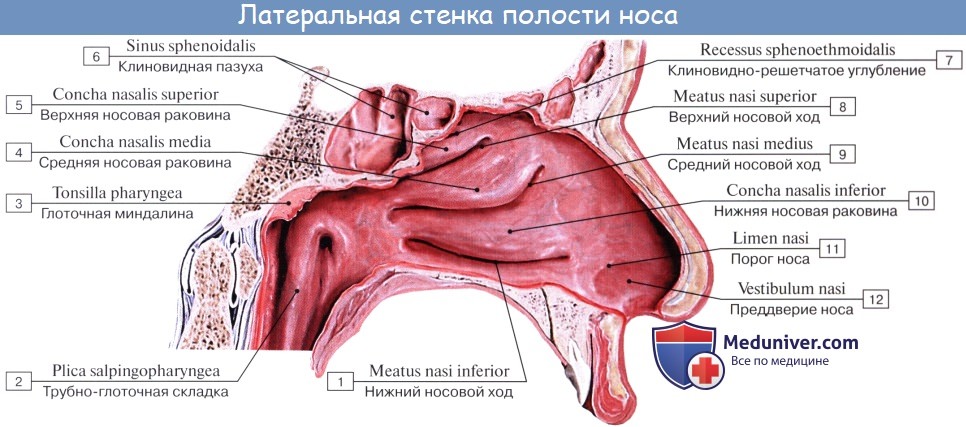
Как отмечалось в разделе остеологии, носовая полость поделена носовой перегородкой, septum nasi (сзади костной, а спереди хрящевой), на две симметричные половины, которые спереди сообщаются с атмосферой через наружный нос при помощи ноздрей, а сзади — с глоткой посредством хоан.
Стенки полости вместе с перегородкой и раковинами выстланы слизистой оболочкой, которая в области ноздрей сливается с кожей, а сзади переходит в слизистую оболочку глотки.
Слизистая оболочка носа (греч. rhinos — нос; отсюда ринит — воспаление слизистой оболочки полости носа) содержит ряд приспособлений для обработки вдыхаемого воздуха.
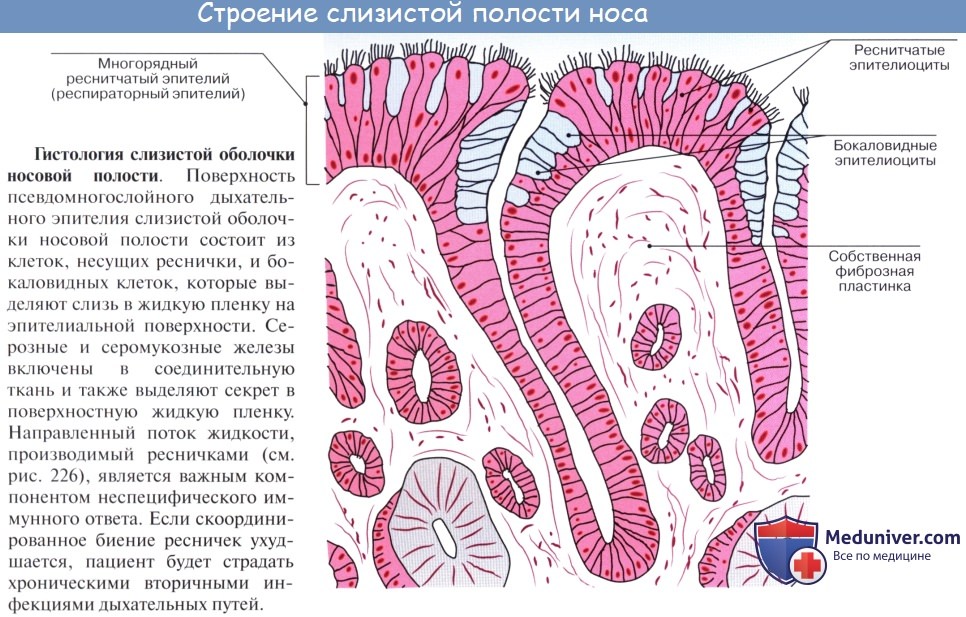
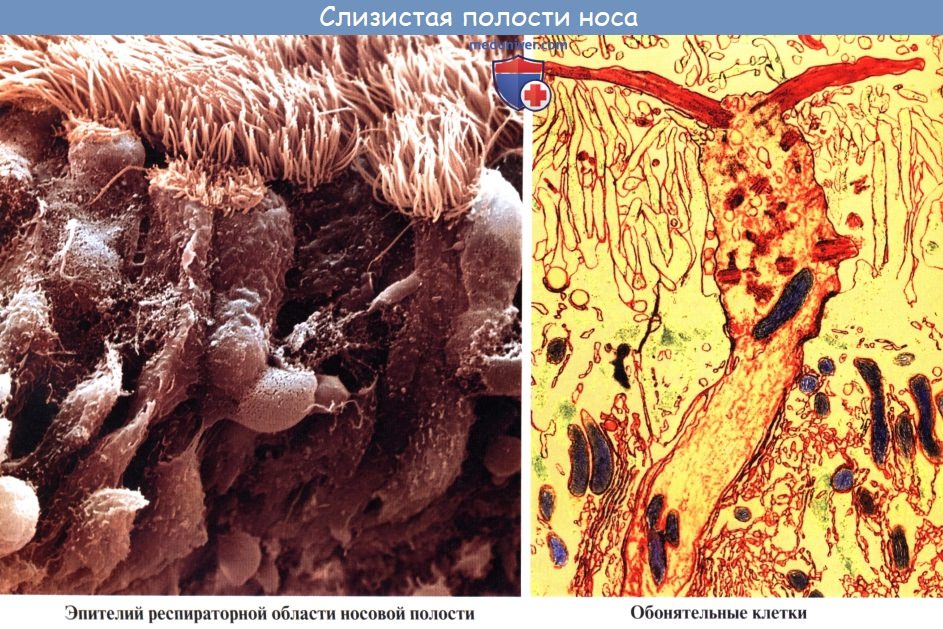
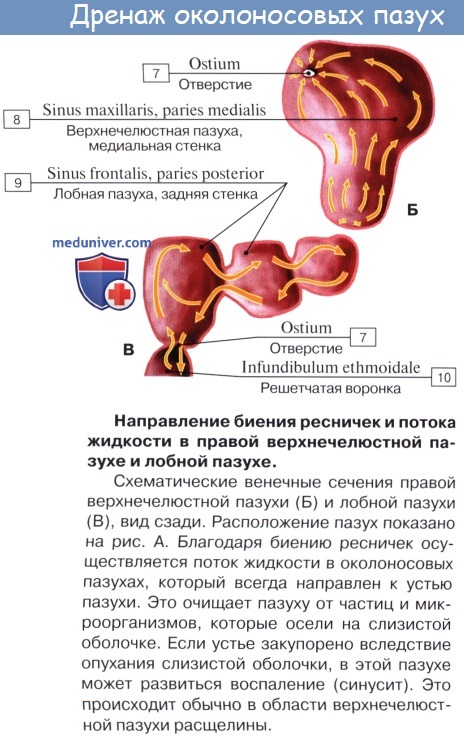
Во-первых, она покрыта мерцательным эпителием, реснички которого образуют сплошной ковер, на который оседает пыль. Благодаря мерцанию ресничек осевшая пыль изгоняется из носовой полости.
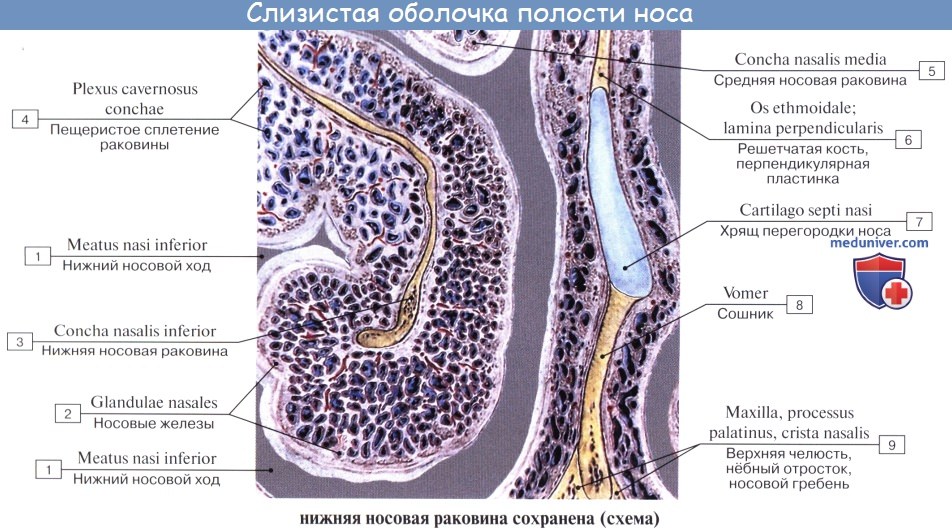
Во-вторых, слизистая оболочка содержит слизистые железы, glandulae nasi, секрет которых обволакивает пыль и способствует ее изгнанию, а также увлажняет воздух.
В-третьих, слизистая оболочка богата венозными сосудами, которые на нижней раковине и на нижнем краю средней раковины образуют густые сплетения, похожие на пещеристые тела, которые могут набухать при различных условиях; повреждение их служит поводом к носовым кровотечениям. Значение этих образований состоит в том, чтобы обогревать проходящую через нос струю воздуха.
Описанные приспособления слизистой оболочки, служащие для механической обработки воздуха, расположены на уровне средних и нижних носовых раковин и носовых ходов. Эта часть носовой полости называется поэтому дыхательной, regio respiratoria. В верхней части носовой полости, на уровне верхней раковины, имеется приспособление для контроля вдыхаемого воздуха в виде органа обоняния, поэтому верхнюю часть носовой полости называют обонятельной областью, regio olfactoria.
Здесь заложены периферические нервные окончания обонятельного нерва — обонятельные клетки, составляющие рецептор обонятельного анализатора.
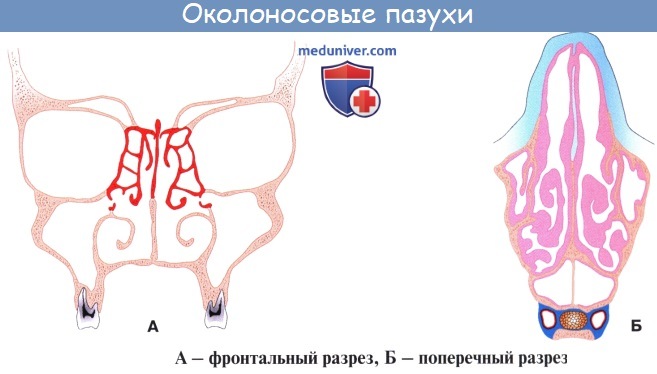
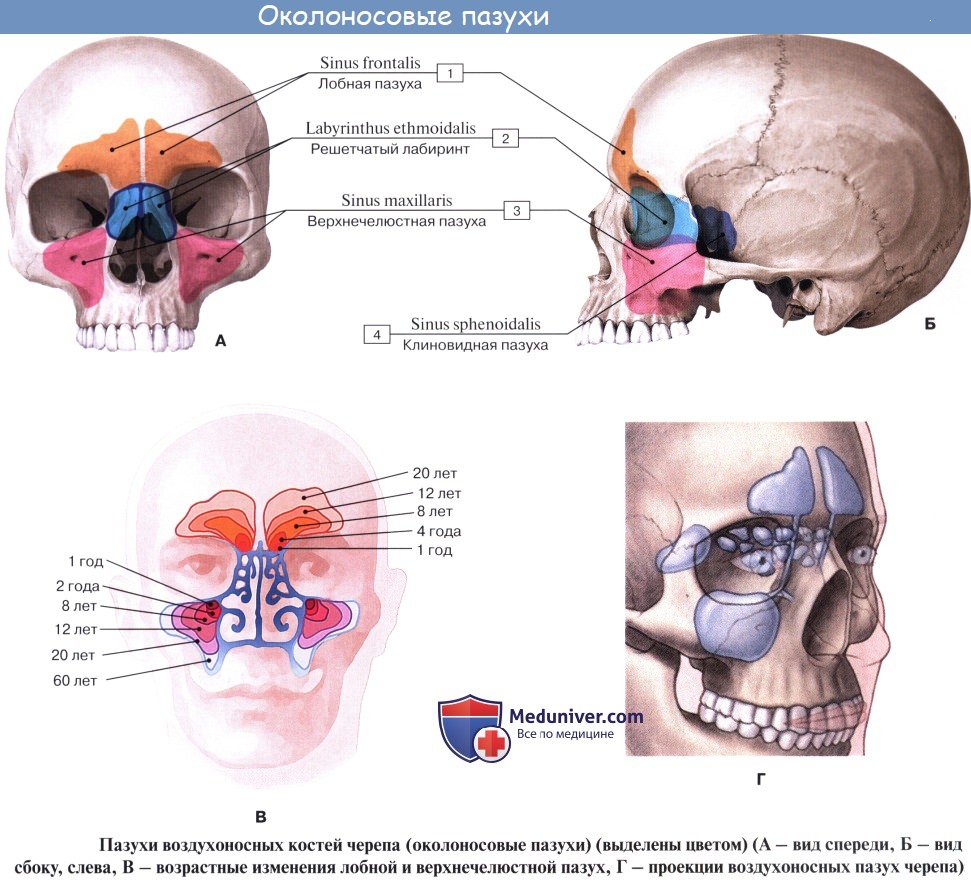
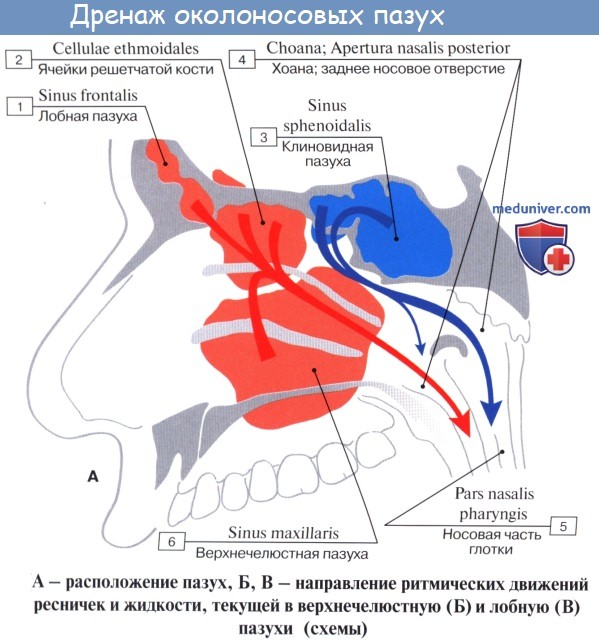
Дополнительным приспособлением для вентиляции воздуха служат околоносовые пазухи, sinus paranasales, также выстланные слизистой оболочкой, являющейся непосредственным продолжением слизистой носа. Это описанные в «Остеологии»:
1) верхнечелюстная (гайморова) пазуха, sinus maxillaris; широкое на скелетированном черепе отверстие гайморовой пазухи закрывается слизистой оболочкой, за исключением небольшой щели;
2) лобная пазуха, sinus frontalis;
3) ячейки решетчатой кости, cellulae ethmoidales, составляющие в целом sinus ethmoidalis;
4) клиновидная пазуха, sinus sphenoidalis.
При осмотре носовой полости у живого (риноскопия) слизистая оболочка имеет розовую окраску. Видны носовые раковины, носовые ходы, ячейки решетчатой кости и отверстия лобной и верхнечелюстной пазух. Наличие носовых раковин и околоносовых пазух увеличивает поверхность слизистой оболочки, соприкосновение с которой способствует лучшей обработке вдыхаемого воздуха.
Свободная циркуляция воздуха, необходимого для дыхания, обеспечивается неподатливостью стенок носовой полости, состоящей из костей (см. «Остеология»), дополняемых гиалиновыми хрящами.
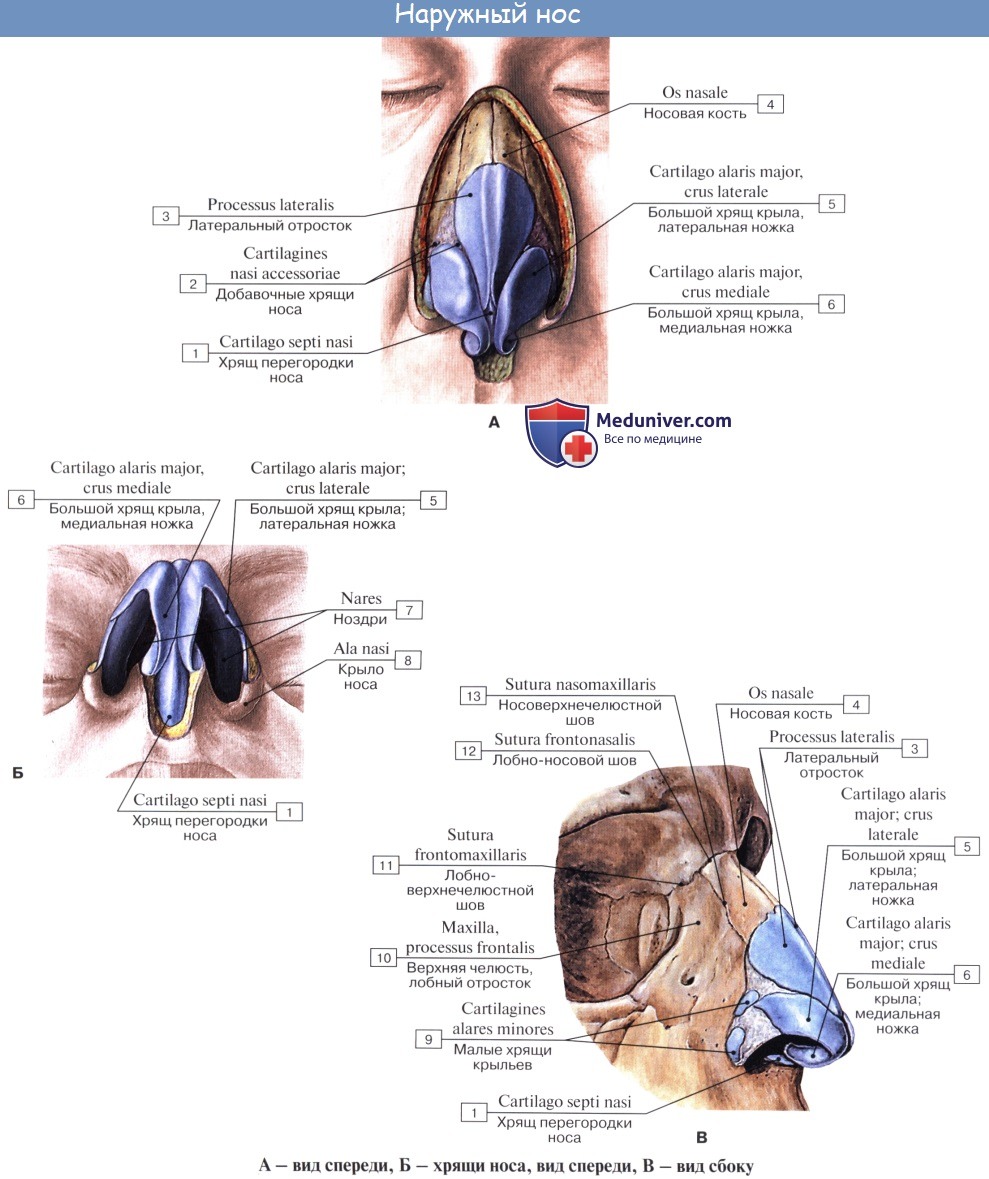
Хрящи носа являются остатками носовой капсулы и образуют попарно боковые стенки (боковые хрящи, cartilagines nasi laterales), крылья носа, ноздри и подвижную часть носовой перегородки (cartilagines alares majores et minores), а также носовую перегородку — непарный хрящ носовой перегородки (cartilago septi nasi).
Кости и хрящи носа, покрытые кожей, образуют наружный нос, nasus extemus. В нем различают корень носа, radix nasi, расположенный вверху, верхушку носа, apex nasi, направленную вниз, и две боковые стороны, которые сходятся по средней линии, образуя спинку носа, dorsum nasi, обращенную вперед.
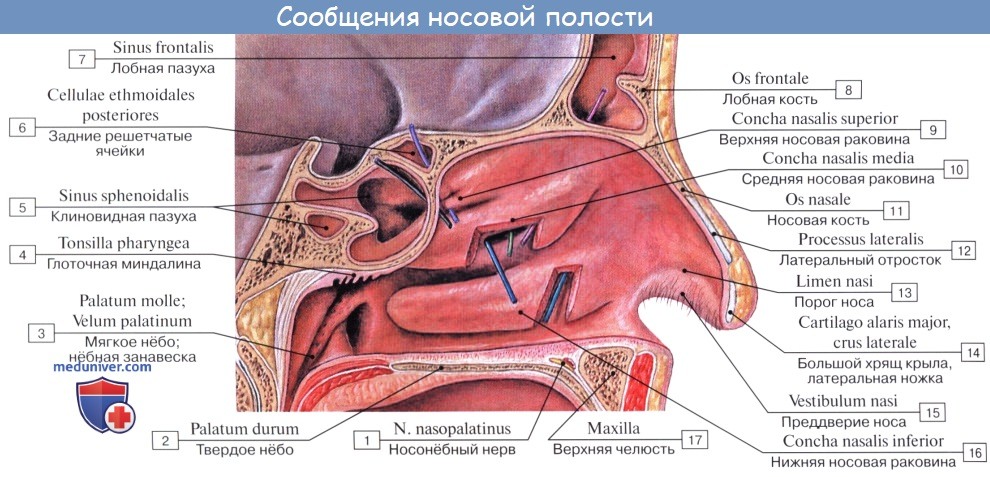
Нижние части боковых сторон носа, отделенные бороздками, образуют крылья носа, alae nasi, которые своими нижними краями ограничивают ноздри, служащие для прохождения воздуха в носовую полость. Ноздри человека в отличие от всех животных, в том числе и приматов, обращены не вперед, как у них, а вниз. Благодаря этому струя вдыхаемого воздуха направляется не прямо назад, как у обезьян, а вверх, в обонятельную область, и совершает длинный дугообразный путь к носоглотке, что способствует обработке воздуха.
Выдыхаемый воздух проходит по прямой линии нижнего носового хода.
Выступающий наружный нос является специфической особенностью человека, так как нос отсутствует даже у человекообразных обезьян, что, по-видимому, связано с вертикальным положением тела человека и преобразованиями лицевого скелета, обусловленными, с одной стороны, ослаблением жевательной функции и с другой — развитием речи.
Из носовой полости вдыхаемый воздух через хоаны попадает в носоглотку, далее в ротовую часть глотки и затем в гортань. Дыхание возможно и через рот, однако отсутствие в ротовой полости приспособлений для контроля и обработки воздуха обусловливает у лиц, дышащих через рот, частые заболевания. Поэтому необходимо следить за тем, чтобы дыхание совершалось через нос.
Источник