Состав крови у крыс
В настоящее время используются различные модели атеросклеротического поражения стенки сосудов. Они могут быть вызваны самыми различными факторами: механическими, химическими, иммунологическими, а также диетой [7]. Модели на животных позволяют изучать не только стадии развития атеросклеротического процесса, начиная от самой ранней, но и возможности управления этим процессом. Наиболее популярной является модель экспериментальной гиперхолестеринемии, вызванной путем скармливания животным диеты с избыточным количеством холестерина и насыщенных жирных кислот [2, 3, 8].
У грызунов (мышей и крыс), в отличие от человека, в плазме крови отсутствует белок, переносящий эфиры холестерина с липопротеинов высокой плотности на липопротеины низкой и очень низкой плотности (cholesteryl ester transfer protein, CETP), и это является одной из главных причин их резистентности к развитию атеросклеротического процесса [15]. Отсутствие белка — передатчика эфиров холестерина не является единственным отличием метаболизма липопротеинов у грызунов по сравнению с человеком, грызуны имеют и другие особенности метаболизма липопротеинов: высокий уровень циркулирующих липаз [5] и специфичного белка — переносчика фосфолипидов (specific phospholipid transfer protein, PLTP) [10], что и объясняет их устойчивость к атеросклерозу. Однако у гипотиреоидных мышей и крыс эта устойчивость резко снижается, что позволяет получать информацию о факторах, способствующих развитию атеросклеротического процесса, а также о возможности разработки новых диагностических и терапевтических стратегий.
Цель исследования – изучение показателей липидного обмена и спектральных характеристик белкового состава липопротеинов плазмы крови у гипотиреоидных и эутиреоидных крыс на модели экспериментальной гиперхолестеринемии.
Материал и методы исследования
Эксперимент продолжительностью 68 сут выполнен на 18 крысах-самцах Вистар массой 390–560 г. Животных содержали в индивидуальных клетках, они имели свободный доступ к воде. Крысы I группы получали атерогенную диету (модель алиментарной гиперхолестеринемии): холестерин (Panreac Quimica SA, Испания) в дозе 25 мг/100 г массы тела, добавленный в стандартный лабораторный рацион. Крысы II группы получали ту же атерогенную диету и антитиреоидный препарат мерказолил («Акрихин», Россия) в дозе 1 мг/100 г массы тела, добавленные в стандартный лабораторный корм. Кормление животных происходило по схеме: один день – атерогенная диета (группа I) или атерогенная диета с добавлением мерказолила (группа II); второй день – голодание; вода ad libitum каждый день. Контрольную группу составили крысы, содержавшиеся в стандартных условиях вивария и получавшие стандартный рацион каждый день. В каждой группе было по 6 крыс, все животные дожили до конца эксперимента. В отношении экспериментальных животных были соблюдены все правила и рекомендации Европейской конвенции по защите позвоночных животных, используемых в экспериментальных работах.
Показатели липидного обмена в плазме крови: общий холестерин (ОХС), холестерин липопротеинов высокой плотности (ХС-ЛПВП), холестерин фракции липопротеинов низкой и очень низкой плотности (ХС-ЛПНП + ХС-ЛПОНП), триглицериды (ТГ) определяли энзиматическим методом с использованием наборов «Biocon» (Германия) на биохимическом анализаторе «Labsystem» (Финляндия). Оценку тиреоидного статуса – концентрацию тироксина (Т4) и трийодтиронина (Т3), проводили иммунохемилюминесцентным методом с использованием наборов фирмы «Immunotech» (Чехия) на люминометре LM-01A (Bekman Coulter Company). Твердофазный иммуноферментный анализ (тИФА) аполипопротеинов А-I и В (апоА-I и апоВ) выполняли непрямым методом, описанным нами ранее [4]. Индекс атерогенности рассчитывали как отношение (ОХС – ХС-ЛПВП)/ХС-ЛПВП, индекс Авогаро – как отношение концентрации апоА-I к концентрации апоВ (апоА-I/апоВ) [6].
Липопротеины выделяли из плазмы крови методом изоплотностного ультрацентрифугирования в растворах KBr в присутствии 3 мМ ЭДТА-Na2 на центрифуге «Optima L-90K» («Beckman Coulter») с использованием углового ротора 70.1 Ti при 105000 g в течение 24 ч [11]. Получали две основные фракции липопротеинов: ЛПОНП + ЛПНП (0,94 Примечания: * – p
Источник
Вариабельность биохимических показателей крови и установление референсных интервалов в доклинических исследованиях. Сообщение 1: крысы
Н.Г. Войтенко, кандидат биологических наук, руководитель лаборатории биохимии и гематологии,
М.Н. Макарова, доктор медицинских наук, директор,
А.А. Зуева, токсиколог
АО «НПО «ДОМ ФАРМАЦИИ»,
188663, Россия, Ленинградская обл., Всеволожский район, г.п. Кузьмоловский, ул. Заводская, д. 3, к. 245
Резюме
Установление корректных референсных интервалов для лабораторных показателей актуально как в клинической практике, так и при проведении исследований на животных. Проведен ретроспективный анализ данных по 11 биохимическим показателям сыворотки крови крыс на большой выборке животных (196 самцов и 184 самки крыс, в возрасте 12–20 нед, массой 250–350 г).
Установлено, что в крови крыс наиболее часто наблюдаются статистические выбросы среди таких показателей, как аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ), выбросы других показателей, существенно реже. Этот факт необходимо учитывать при планировании исследований, что требует увеличения числа повторностей при проведении анализа показателей.
Установлены референсные интервалы для креатинина, мочевины, АСТ, АЛТ, щелочной фосфатазы, холестерина, триглицеридов, общего белка, альбумина, глюкозы и общего билирубина. Рассчитана межиндивидуальная вариабельность по указанным биохимическим показателям. Наибольшая межиндивидуальная вариабельность (более 30%) установлена для таких показателей, как активность щелочной фосфатазы, уровень триглицеридов, глюкозы и общего билирубина.
Проведено сравнение полученных в ходе ретроспективного анализа данных с референсными интервалами биохимических показателей крови крыс различных линий из 3 крупных питомников (Charles River, Taconic и Envigo). Представленные в литературе референсные интервалы также свидетельствуют о высокой вариабельности активности ряда ферментов (в том числе щелочной фосфатазы), а также концентрации глюкозы, общего билирубина и триглицеридов в крови крыс. Рассчитанные нами референсные интервалы хорошо сопоставимы с данными, представленными в литературе.
Полученные результаты свидетельствуют о предпочтительном использовании именно ретроспективного анализа данных, который позволяет получить более корректные референсные интервалы на большей выборке животных, без ущерба для этических принципов. Сравнительный анализ межиндивидуальной вариабельности биохимических показателей крови крыс и человека демонстрирует наличие видовых различий, которые необходимо учитывать при рассмотрении результатов доклинических исследований.
Введение
Биохимический анализ крови – неотъемлемая часть доклинических исследований, проводимых на лабораторных животных. В большинстве случаев дизайн эксперимента предусматривает сравнение показателей животных из интактных и подопытных групп. Число животных в группе, как правило, не превышает 10, что, с точки зрения статистики, является малой выборкой [1]. Для заключения о наличии/отсутствии клинической значимости наблюдаемых отклонений необходимо иметь представление о вариабельности изучаемых показателей в данной популяции животных, т.е. о значениях референсных интервалов (РИ).
В клинической практике применяют несколько способов установления РИ. Классический подход – формирование референсной группы с применением строгих правил включения и исключения, обследование и последующий расчет РИ. Это является трудоемким и дорогостоящим процессом для медицинских учреждений, а в доклинических исследованиях еще и противоречит нормам биоэтики, так как для установления РИ в каждой половой или возрастной группе требуется не менее 120 наблюдений [2, 4]. Другой подход – апостериорный (ретроспективный) – позволяет использовать для расчета РИ результаты, ранее полученные в данной лаборатории, за определенный период времени. Также на практике прибегают к данным в справочной литературе, что в доклинических исследованиях оправдано при анализе новых или редко используемых показателей или экзотических видов лабораторных животных.
В связи с изложенным, цель нашей работы – установление референсных интервалов для основных биохимических показателей, используемых в доклинических исследованиях, и оценка частоты статистических выбросов для этих показателей. Для установления РИ был выбран ретроспективный метод, что позволило включить в массив данных большое число животных, не нарушая при этом биоэтические принципы. Крысы являются одним из самых востребованных тест-систем. Поэтому мы рассматриваем вопрос установления РИ биохимических показателей на примере этих животных.
Материал и методы
Для ретроспективного анализа использовали данные, полученные в нашем центре, в период проведения текущих исследований с октября 2018 по октябрь 2019 г. В массив данных включали животных интактных групп из 26 исследований, возраст самцов и самок аутбредных крыс составлял 12–20 нед, масса тела – 250–350 г (питомник АО «НПО «ДОМ ФАРМАЦИИ», Россия). В сформированном массиве находились данные, полученные ранее от 196 самцов и 184 самок крыс. В сыворотке крови этих животных на автоматическом биохимическом анализаторе Rendom Access A-25 (Испания) были рассчитаны следующие показатели: креатинин, мочевина, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), холестерин, триглицериды, общий белок, альбумин, глюкоза и общий билирубин. Концентрацию общего билирубина определяли с помощью набора реактивов Вектор-Бест (Россия), остальные аналиты – с помощью наборов Bio Systems (Испания). Статистическую обработку результатов осуществляли в программе Statistica.10: статистические выбросы по методу Тьюки, вид распределения определяли по критерию Шапиро–Уилка, сравнение между животными разного пола по U-критерию Манна Уитни и t-критерию Стьюдента.
Результаты и обсуждение
Для устранения влияния аномальных значений из массива данных были исключены статистические выбросы, которые определяли отдельно для каждого показателя и пола животных по методу Тьюки. Из дальнейшей работы были исключены данные, лежащие за пределами интервала (Q1–1,5•IQR)-(Q3+1,5•IQR), где Q1 и Q3 – границы 1-го и 3-го квартилей, а IQR – межквартильный интервал. В этот интервал попадали как «extremes», или жесткие выбросы, так и «outliers», или мягкие выбросы.
После исключения выбросов массивы данных были проанализированы на соответствие действующим в центре РИ. Последние были рассчитаны с применением классического подхода, но на ограниченной выборке животных (20 голов – 10 самцов и 10 самок). Данные о доле статистических выбросов, в том числе «extremes», по каждому показателю и выходящих за пределы РИ значений представлены в табл. 1.
Доли статистических выбросов и отклонений от действующих РИ
Источник
Состав крови у крыс
У крыс после введения внутрибрюшинно CCl4 (100 мкг/кг) через 24 часа развивался выраженный гепатит. Отмечено снижение активности синтеза оксида азота в эндотелиальных и гладкомышечных клетках кровеносных сосудов [8]. Острое отравление тетрахлорметаном per os крыс в дозе 0,75 ЛД50 через 4 суток вызывало снижение основных гуморальных и клеточных иммунных реакций [2].
При хроническом токсическом гепатите крыс, вызванном введением 4-х хлористого углерода, наблюдалось увеличение паракортикальной зоны в брыжеечных лимфатических узлах, что свидетельствует, по мнению авторов, об усилении иммунного ответа по гуморальному типу [7].
После трехкратного введения 50 % масляного раствора CCl4 через день крысам отмечено снижение в печени нуклеиновых кислот на 16 % и общего белка на 18 % по сравнению с показателями интактных животных [4].
Хроническая интоксикация животных тетрахлорметаном вызывала выраженные дистрофические и воспалительные изменения в печени и в регионарных лимфатических узлах. При беременности у самок и у потомства эти изменения сохранялись, но были выражены меньше. Авторы считают, что в этих условиях у животных лучше сохранялась дренажно-детоксикационная функция лимфатической системы [5]. Радиоиммунным методом установлено увеличение содержания ренина, ангиотензина I и II, альдестерона и активности ангиотензин-конвертирующего фермента при токсическом гепатите, вызванным введением CCl4 крысам [9].
В последние годы среди неинвазивных методов диагностики хронического гепатита и портальной гипертензии важное место отводится ультразвуковым исследованиям [7, 1].
Материалы и методы исследования
Эксперименты проведены на 102 половозрелых белых лабораторных крысах-самцах линии Вистар, массой 180-250 гр. Для создания модели токсического гепатита использовали 50 % масляный раствор четыреххлористого углерода (CCl4), который вводился внутрибрюшинно (0,3 мг/кг) один раз в течение 3 суток через день. Наличие токсического гепатита у крыс было подтверждено гистологическими и биохимическими исследованиями.
Острые опыты проводились на 2 группах крыс: 1-я группа крыс – контрольная (24 интактных крыс) и 2-я группа – это крысы с моделью токсического гепатита (78 крыс) с соблюдением основных принципов Хельсинской конвенции о гуманном отношении к лабораторным животным. Через 15 суток после интоксикации крыс 4-х хлористым углеродом под эфирным наркозом прижизненно регистрировали лимфоток из грудного и кишечного лимфатического сосуда.
Морфологический состав крови у крыс с токсическим гепатитом изучали на гематологическом анализаторе SYSMEXKX-219 (Япония). Время свертывания крови и лимфы определяли по Сухареву, вязкость – на вискозиметре ВК-4, рН – на анализаторе OSMETECHOPTITMССА (США).
Определение морфологического состава лимфы проводили в камере Горяева с сеткой Бюркера. Определяли число лейкоцитов, лейкоцитарную формулу – в сухих мазках лимфы, окрашенных по методу С.П. Романовского. Для изучения гистологических препаратов использовали световой микроскоп Leica – DМ-1000.
Изучался уровень кровоснабжения в печени, в частности, в разных долях печени: правой и левой методом импендансной реографии на реографе «Рео-Мицар» (Россия).
В наших опытах определялась объемная скорость кровотока в магистральных сосудах брюшной полости: в печеночной артерии, в воротной вене, в селезеночной артерии и вене, нижней полой вене на ультразвуковом лазерном приборе Допплера «Сономед-300» (Россия). Комплексное ультразвуковое исследование кровенаполнения сосудов выполнялось на наркотизированных крысах строго натощак с конвексным датчиком частотой 8 МГц [20, 21]. Линейная скорость кровотока определялась в основном стволе воротной вены на уровне ворот печени при сканировании через межреберья.Расчет кровотока производили в см/с. Каждое измерение проводили в течение не менее 10 минут.
Полученный материал обработан на компьютере вариационно-статистическим методом с использованием критерия Стьюдента.
Результаты исследования и их обсуждение
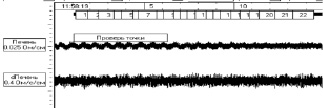
Результаты реогепатографического исследование у крыс контрольных группы представляли собой чередующие систолические волны достаточной амплитуды, с закругленной вершиной и диастолическим подъемом. Скорость быстрого кровенаполнения составляла в контроле 1,02 ± 0,06 Ом/с, скорость медленного кровенаполнения 0,15 ± 0,02 Ом/с. На фоне токсического гепатита наблюдали, что форма кривой характеризовалась появлением заостренной и зазубренной, а в некоторых случаях платообразной вершины.
Результаты исследований на крысах с токсическим гепатитом показали противоречивые данные, в одних случаях наблюдали увеличение амплитуды систолической волны на 65 %.Скорость быстрого кровенаполнения составляла 6,06 ± 0,5 Ом/с, а медленного кровенаполнения – 4,05 ± 0,02 Ом/с. В других случаях наблюдали уменьшение амплитуды диастолической и систолической волны на 45 %, с одновременным уменьшением скорости быстрого кровенаполнения до 0,70 ± 0,02 Ом/с, но возрастала скорость медленного кровенаполнения (рисунок).
а) реогепатограмма контрольной группыу крыс
б) реогепатограмма на фоне токсического гепатита у крыс
Кривая реогепатограммы у крыс с контрольной группой и на фоне токсического гепатита
По мнению некоторых авторов, изменение кривой реогепатограммы происходит разнонаправлено, но, в основном, зависит от этиологии заболеваниях [9]. При вирусной этиологии происходит снижение амплитуды систолической волны, при токсическом гепатите происходит обратный эффект т.е. идет увеличение амплитуды систолической волны.
Изучение скорости кровотока методом лазерной ультразвуковой доплерографии у крыс на фоне хронической затравки СCl4 показало, что скорость линейного кровотока в воротной вене снижалась, а в печеночной артерии скорость кровотока повышалась по сравнению с контрольной группой. Пульсационный индекс и индекс периферического сопротивления уменьшались в воротной вене и в печеночной артерии на 25 % .Изменение этих показателей указывает на наличие нарушения гемодинамики печени на фоне токсического гепатита у крыс и начальным формированием проявлений портальной гипертензии (таблица).
Параметры кровотока в сосудах портальной системы
Источник