Особенности дыхательной системы животных, используемых в доклинических исследованиях, которые необходимо учитывать при моделировании патологий легких
Д.Р. Каргопольцева 1 , ветеринарный врач, ORCID: 0000-0002-9944-5223;
А.Е. Кательникова 1 , кандидат медицинских наук, руководитель группы специфической токсикологии, ORCID: 0000-0003-3203-9869;
К.Л. Крышень 1 , кандидат биологических наук, руководитель отдела токсикологии и микробиологии, ORCID: 0000-0003-1451-7716;
Я.А. Гущин 2 , руководитель отдела гистологии и патоморфологии, ORCID: 0000-0002-7656-991Х
1 ООО «Институт доклинических исследований»,
188663, Россия, Ленинградская обл., Всеволожский район, г.п. Кузьмоловский, ул. Заводская, д. 3, к. 245;
2 НПО «Дом Фармации»,
188663, Россия, Ленинградская обл., Всеволожский район, г.п. Кузьмоловский, ул. Заводская, д. 3, к. 245
Резюме
Дыхательная система является одной из важнейших систем организма, обеспечивающей поступление кислорода из атмосферного воздуха в дыхательные пути, осуществляющие газообмен и выведение углекислого газа обратно в окружающую среду. Заболевания дыхательной системы влияют на жизнь большого числа людей в мире. При планировании исследований по изучению фармакологической активности и токсичности лекарственных препаратов при эндотрахеальном и ингаляционном путях введения следует принимать во внимание видовые особенности анатомии, микроструктуры и патофизиологических процессов у различных видов животных, в том числе и в сравнении с человеком.
В настоящем обзоре рассмотрены анатомические и гистологические особенности дыхательной системы мышей, крыс, морских свинок, кроликов, свиней и собак, которые используются в биомедицинских исследованиях, и их сравнительная характеристика относительно устройства дыхательной системы у человека. Так, при изучении данных литературы обнаружено, что наибольшее сходство с дыхательной системой человека как по макроскопическим данным, так и на микроскопическом уровне, выявлено у морских свинок и карликовых свиней. Поиск статей, опубликованных на английском языке, осуществляли по базам данных Google Scholar и PubMed (1970–2020), на русском языке – по базе данных научной электронной библиотеки eLIBRARY.RU. Помимо рассмотрения анатомических и гистологических особенностей строения дыхательной системы лабораторных животных, в данный обзор также были включены модели патологий легких, воспроизводимых на перечисленных животных. Так, на мышах и крысах воспроизводят хроническую обструктивную болезнь легких (ХОБЛ), фиброз, воспаление, эмфизему. Мыши определенных линий, как и морские свинки, используются для моделирования бронхиальной астмы. Лабораторных животных также применяют при воспроизведении бактериальных и вирусных болезней дыхательной системы. Таким образом, требуется очень тщательный подход к подбору тест-системы при моделировании заболеваний дыхательной системы. Это необходимо для получения более схожих клинических симптомов и патофизиологических процессов с человеком при тех или иных патологиях легких, что в дальнейшем позволит лучше прогнозировать фармакодинамические и токсические эффекты лекарственных препаратов в клинической практике.
Введение
Дыхание в организме человека и животных представляет собой процесс использования кислорода клетками тканей в биологическом окислении с образованием энергии и конечного продукта дыхания – углекислого газа.
Дыхательная система обеспечивает газообмен между атмосферным воздухом и легкими, в результате кислород из легких поступает в кровь, которая переносит его к тканям организма, а углекислый газ транспортируется от тканей в противоположном направлении [1]. У млекопитающих газообмен происходит в легких, находящихся в грудной клетке, путем сокращения мышц-вдыхателей и выдыхателей, которые поочередно расширяют и сужают грудную клетку, а вместе с ней и легкие. Это обеспечивает всасывание воздуха через воздухопроводящие пути в легкие (вдох) и его обратное выталкивание (выдох). Дыхательная система включает в себя верхние и нижние дыхательные пути. Верхние дыхательные пути – это нос и носовая полость, придаточные носовые полости и гортань (иногда гортань относят к нижним дыхательным путям). Нижняя дыхательная система может быть разделена на две структурные и функциональные части – проводящую и дыхательную. Проводящая часть, которая транспортирует газы в легкие и обратно, включает трахею, бронхи и простирается до терминальных бронхиол. Дыхательная часть состоит из бронхиол, альвеолярных ходов, альвеолярных мешочков и альвеол.
Для проведения доклинических исследований лекарственных средств с целью изучения токсичности при эндотрахеальном и ингаляционном введении и оценки фармакологической активности на соответствующих модельных патологиях используют различные виды животных, которые, в свою очередь, имеют различия в строении дыхательной системы, как анатомические, так и гистологические, которые необходимо учитывать, в том числе в сравнении с таковыми у человека.
Статья представляет собой анализ данных литературных источников (1970–2020), входящих в базы данных Google Scholar и PubMed (статьи, опубликованные на английском языке) и научной электронной библиотеки eLIBRARY.RU (статьи, опубликованные на русском языке). Поиск проводили по следующим семантическим полям: анатомия дыхательной системы, животные, мыши, крысы, морские свинки, карликовые свиньи, собаки, патологии легких. В анализ включались публикации, посвященные сравнительной физиологии, анатомии и гистологии верхних и нижних дыхательных путей человека и лабораторных животных, а также моделированию патологий легких у различных видов животных.
Из анализа исключались неопубликованные статьи и результаты клинических исследований.
Мыши широко используются в исследованиях патологий легких, например при моделировании повреждения легких с применением солевого раствора, олеиновой кислоты, липополисахарида (LPS), а также на модели повреждения при вдыхании сигаретного дыма [2].
Отмечается, что существуют значительные отличия легочных реакций в ответ на вдыхание токсичных химических веществ у различных линий мышей. Так, например, мыши линии C57BL/6 менее чувствительны к острому повреждению легких по сравнению с другими инбредными линиями мышей [2–4]. Поскольку мышиная модель повреждения легких довольно хорошо изучена, данный вид животных может выступать в качестве оптимальной модели для оценки и разработки стратегии лечения повреждения легких.
Особенности дыхательных путей у мышей
При изучении дыхательной системы мышей и планировании исследований при моделировании патологий легких следует отметить несколько различий между структурами дыхательных путей человека и мыши (табл. 1) [2, 5]. Мыши в отличие от человека имеют облигатное носовое дыхание и неэффективную фильтрацию дымсодержащего аэрозоля [6]. В легких мыши насчитывается 5 долей: 1 доля в левом легком и 4 в правом (краниальная, медиальная, каудальная и добавочная доли) (рис. 1 и 2) [2, 7]. Однако в некоторых номенклатурах описывается наличие 5 долей в правом легком (добавочная подразделяется на промежуточную и диафрагмальную) [8]. У человека правое легкое разделено на 3 доли – проксимальную, медиальную и дистальную, левое легкое имеет проксимальную и дистальную доли.
Легкие мышей имеют сильно моноподиальный характер ветвления дыхательных путей в отличие от легких человека, у которых относительно дихотомический характер ветвления. Терминальные ветви дыхательного дерева ведут непосредственно к альвеолярным ходам [2, 8]. У мышей отсутствуют прекапиллярные бронхолегочные анастомозы. Альвеолы мышей очень малы по сравнению с альвеолами человека – средний линейный перехват альвеолы у мышей составляет 80 мкм, в то время как у человека – 210 мкм. Также имеются отличия в толщине воздушно-кровяного (аэрогематического барьера): 0,32 мкм у мышей и 0,62 мкм у людей [9].
Трахея мышей и человека выстлана многорядным столбчатым эпителием. Эпителий трахеи у мышей тоньше, чем у людей. У людей среди популяции клеток, выстилающих трахею, выделяют преимущественно реснитчатые, бокаловидные и базальные клетки, тогда как трахея мышей в основном выстлана нереснитчатыми клетками, к которым также относятся секреторные клетки или клетки Клара. Эти клетки выполняют несколько функций, среди которых секреция антимикробных белков для защиты дыхательных путей. У мышей в отличие от человека эпителий проксимальных дыхательных путей поддерживается скудной сетью базальных клеток. У человека собственная пластинка слизистой оболочки включает в себя большое количество лимфатических фолликулов, которые являются частью лимфоидной ткани. У мышей со статусом SPF очень мало лимфатических фолликулов в собственной пластинке слизистой оболочки. Подслизистые железы мышей располагаются в основном в проксимальной части трахеи (ближе к гортани) в пределах первых восьми хрящевых колец. У человека подслизистая оболочка содержит многочисленные слизисто-белковые железы, которые продуцируют слизь.
В главных бронхах мышей в отличие от человека отсутствуют подслизистые железы, а также насчитывается менее 1% бокаловидных клеток в эпителии. Таким образом, количество клеток, продуцирующих слизь, значительно различается между человеком и мышами [2, 7, 10]. Паренхима легких у мышей состоит только из бронхиол, в то время как у человека она включает как бронхи, так и бронхиолы (рис. 3) [2, 8].
Также у мышей нет хорошо развитых респираторных бронхиол (или они вовсе отсутствуют), поэтому дыхательная зона легких у них состоит лишь из альвеолярных ходов и альвеол, в то время как у человека еще имеются респираторные бронхиолы.
Несмотря на описанные различия, на описанные различия, мыши могут выступать в качестве тест-системы для моделирования ХОБЛ I или II стадии (классификация, описанная Global initiative for Obstructive Lung Disease — GOLD) и демонстрировать симптомы, характерные для человека, страдающего ХОБЛ: воспаление легких с накоплением макрофагов, нейтрофилов и лейкоцитов, медиаторов воспаления легких (цитокины, хемокины и протеазы), нарушение функции легких, эмфизема, гиперсекреция слизи, утолщение и ремоделирование дыхательных путей за счет накопления воспалительных клеток и метаплазии бокаловидных клеток с сужением, деформацией и закупоркой слизью дыхательных путей, ремоделирование сосудов легких, легочная гипертензия [11]. Однако для моделирования хронического бронхита или III и IV стадии ХОБЛ мыши не подходят, поскольку либо выздоравливают, либо погибают до того, когда можно оценить интересующие параметры [12, 13]. Также мыши могут быть использованы в качестве тест-системы при моделировании астмы, но стоит иметь в виду, что отсутствие обширного легочного кровообращения может оказывать влияние на адгезию и миграцию лейкоцитов и как следствие – на воспаление [14–17]. На мышах можно воспроизвести фиброз легких, которому в большей степени подвержены определенные линии мышей (например, C57BL/6, тогда как линия мышей Balb/c относительно устойчива к развитию данной патологии) [18, 19].
Крысы
Существуют многочисленные модели на крысах, которые имитируют болезни человека. В том числе крыс используют в качестве модели повреждения легких при вдыхании дыма [2]. Однако для моделирования повреждения легких крыс применяют реже, чем мышей, так как они обладают резистентностью к развитию симптомов ХОБЛ.
Особенности дыхательных путей у крыс
Легкие крысы имеют значительные отличия от дыхательных путей человека, что следует учитывать при проведении исследований с моделированием повреждения легких. Крысы, как и мыши, имеют облигатное носовое дыхание [20, 21]. Строение легких крыс сходно со строением легких мышей. Правое легкое крысы включает 4 доли (краниальная, медиальная, каудальная и добавочная), а левое представляет собой 1 большую долю (рис. 4, 5) [2, 8]. Однако в статье В.М. Петренко описывается наличие трех «скрытых» долей в левом легком (краниальная, каудальная и добавочная (околоворотная)), которые срослись под давлением правого легкого и сердца [22, 23]. Также, согласно данным статьям, в легком крысы насчитывается не 4, а 5 долей: краниальная, медиальная, каудальная и две добавочные (в составе каудальной).
Легкие крысы, как и мыши, имеют сильно моноподиальный характер ветвления дыхательных путей. У крыс самая толстая легочная вена и самая тонкая легочная артерия из всех видов грызунов [2, 8].
Конечные бронхиолы в легких крыс имеют диаметр 0,2 мм и длину 0,35 мм, тогда как у человека их ширина 0,6 мм и длина 1,68 мм. Осаждение вдыхаемых частиц размером менее 0,5 мкм очень незначительное как у людей, так и крыс. У крыс осаждение частиц максимально при их размере 1 мкм, а у человека – при размере 2–4 мкм. Процент частиц, вдыхаемых человеком и крысами, также различен. Так, для человека поглощение при вдыхании через рот составляет около 50%, а при носовом дыхании – около 25%, в то время как у крыс – около 5%. У крыс гораздо быстрее очищаются слизистые оболочки, чем у людей;10–50% частиц размером 0,1–7 мкм осаждаются в бронхиальном дереве человека и могут быть обнаружены даже через 24 ч, а у крыс легкие свободны от частиц уже через 6–8 ч. Возможно, это обусловлено локализацией вдыхаемых частиц в легких: у крыс частицы осаждаются в центральной части легких, а у человека в основном – в периферических частях легкого. Средний линейный перехват альвеолы у крыс составляет 100 мкм, в то время как у человека данный показатель 210 мкм. Также имеются отличия в толщине воздушно-кровяного (аэрогематического) барьера: 0,38 мкм у крыс и 0,62 мкм у людей (см. табл. 1) [2, 9].
У крыс трахея выстлана однорядным столбчатым эпителием. В отличие от мышей у крыс подслизистые железы обнаруживаются в трахее вплоть до бифуркации легких [2, 8, 9]. Отличием эпителиального слоя слизистой оболочки трахеи крыс от человека является практически полное отсутствие бокаловидных клеток, отвечающих за выработку слизистого секрета, а также у них отмечается меньшее количество слизистых желез, которые сконцентрированы в основном в проксимальной части трахеи. У крыс отмечают повышенный мукоцилиарный клиренс, ответственный за местную защиту органов дыхания от внешних воздействий [9]. Дыхательные бронхиолы у крыс появляются через несколько недель после рождения, в то время как у мышей они отсутствуют (рис. 6).
Количество слизистых желез у крыс и других мелких лабораторных животных заметно меньше, чем у более крупных млекопитающих [24]. Несмотря на это, крысы выступают как наиболее часто используемая тест-система при моделировании ХОБЛ, повреждение легких при этом достигается при воздействии сигаретного дыма, липополисахарида [25–28]. Наряду с ХОБЛ у животных развиваются эмфизема и воспаление [29–31]. Также у крыс регистрируют развитие фиброза легких при вдыхании сигаретного дыма, который характерен для курильщиков [32].
Морские свинки
Роберт Кох был первым, кто использовал морских свинок в качестве тест-системы для индукции бактериальных инфекций в 1882 г. [33, 34]. С тех пор они используются в качестве лабораторных животных, хотя и не так широко, как крысы и мыши. Дыхательные пути морских свинок, как и у людей, очень чувствительны к аллергенам, в связи с чем они широко применяются в исследованиях аллергических реакций, астмы и экстремального анафилактического шока [2].
Особенности дыхательных путей у морских свинок
Морские свинки обладают довольно большим сердцем, за счет чего у них сравнительно небольшие легкие в отличие от крыс и мышей. Легкие морских свинок разделены на 7 долей. Правое легкое состоит из краниальной, медиальной, каудальной и добавочной долей, левое – из краниальной, медиальной и каудальной долей (рис. 7, 8). Легкие морских свинок имеют дихотомический характер ветвления дыхательных путей, похожий на таковой у человека [2, 22, 35, 36]. Морские свинки имеют облигатное носовое дыхание [37].
Эпителий трахеи, главных и крупных бронхов у морских свинок выстлан многорядным мерцательным эпителием, который менее развит у мышей и крыс. В верхних дыхательных путях обнаруживаются бокаловидные клетки, клетки Клара и слизистые железы [10, 22]. Сосудистые сплетения в собственной пластинке хорошо выражены, как и у человека. Однако у морских свинок в отличие от мышей, крыс и человека нет слизисто-белковых желез в собственной пластинке слизистой оболочки. У человека имеются хорошо развитые бронхиальные железы, в время как у морских свинок они состоят лишь из нескольких ацинусов (рис. 9) [10, 38, 39].
Нейроэндокринные клетки и нейроэпителиальные тела (нейроэндокринные клетки, организованные в кластеры) у морских свинок расположены по всему эпителию верхних и нижних дыхательных путей, что также характерно для человека [39–41].
И у человека, и у морской свинки спазм гладких мышц дыхательных путей при аллергическом воспалении происходит на фоне выделяемых аутокоидов. У людей и морских свинок гиперчувствительность на аллерген в значительной степени обусловлена активацией гистаминовых H1 и лейкотриеновых cysLT1-рецепторов. Также аллергическое воспаление легких у морских свинок соответствует астматическому состоянию человека. Поэтому морские свинки подходят в качестве тест-системы в исследованиях аллергической реакции и астмы [39, 42, 43]. При воспроизведении ХОБЛ симптомы у морских свинок и человека схожи и включают острую нейтрофилию, накопление моноцитов, повышенную сосудистую проницаемость, секрецию слизи, разрушение альвеол, легочную гипертензию. При заражении морских свинок вирусными инфекциями у животных отмечают схожесть патогенеза с людьми [2, 44]. Также преимуществом морских свинок является наличие кашлевого рефлекса [39, 44, 45]. Таким образом, за счет сходства анатомии и физиологии дыхательной системы с человеком морские свинки часто используются в доклинических исследованиях, связанных с астмой, исследованием аллергических реакций и при воспроизведении ХОБЛ.
Кролики
Филогенетически кролики ближе к людям, нежели грызуны, что отображается анатомическим, физиологическим, генетическим и биохимическим сходством.
Особенности дыхательных путей у кроликов
Кролики имеют облигатное носовое дыхание [46]. Грудная полость кролика относительно размера тела довольно мала. Легкие кролика окружены тонкой плеврой. В легких отсутствует или присутствует плохо развитая междольчатая соединительная ткань. Правое легкое у кроликов разделено на 4 доли (краниальная, медиальная, каудальная и добавочная), левое легкое меньшего размера и разделено на 2 доли (краниальная и каудальная) (рис. 10, 11) [2, 47]. У кроликов относительно узкая трахея делится на 2 главных бронха, которые в свою очередь – на бронхиолы, при этом формируется моноподиальное дыхательное дерево [2, 48].
Эпителий трахеи и главных бронхов кроликов на 50% представлен реснитчатыми, а также бокаловидными клетками (менее распространены, чем в эпителии трахеи человека), клетками Клара и базальными клетками (рис. 12) [2, 49].
Хорошо развитые подслизистые железы у людей располагаются между хрящевыми кольцами трахеи, у кроликов, напротив, подслизистые железы отсутствуют. У кроликов насчитывается 32 порядка бронхов, а у человека – 25. К бронхам 5-го порядка бокаловидные клетки постепенно замещаются клетками Клара. Респираторные бронхиолы у кроликов отсутствуют, в то время как у человека они есть [50, 51]. Эпителий терминальных бронхиол на 50% состоит из реснитчатых клеток и на 50% из клеток Клара. По сравнению с людьми кролики обладают меньшим количеством секреторных клеток в дыхательных путях [2].
Исследования, направленные на изучение реакции дыхательных путей на различные раздражители (гистамин, монофосфат аденозина), показали сходство реакции кроликов с реакцией людей, страдающих астмой. Также на модели аллергии у кроликов получены данные по чувствительности к противоастматическим препаратам (бета-адреномиметики, кортикостероиды, ингибиторы фосфодиэстеразы и теофиллин) [48, 52]. Кроме того, у кроликов наблюдаются схожие с человеком повреждения дыхательных путей, особенно верхних дыхательных путей, при вдыхании дыма. К ним относятся слущивание некротизированных эпителиальных клеток, воспалительная реакция, обструкция дыхательных путей, отек. Однако при выборе кролика в качестве тест-системы для моделирования повреждения легких сигаретным дымом стоит учитывать, что у них отсутствует кашлевой рефлекс [2, 53]. Таким образом, кролики подходят для моделирования ряда легочных заболеваний.
Карликовые свиньи
Все больше и больше заболеваний легких изучается и моделируется на свиньях, что связано со сходством строения их дыхательной системы с человеческой [54]. Cвиньи довольно часто используются в качестве тест-системы для моделирования респираторных заболеваний, вызванных Bordetella pertussis [55], вирусом гриппа, Mycobacterium tuberculosis [56], Pseudomonas aeruginosa [57] и Staphylococcus aureus [58].
Особенности дыхательных путей у карликовых свиней
Верхние дыхательные пути свиней и человека анатомически схожи. Так, по своему анатомическому строению лимфатическое глоточное кольцо (кольцо Вальдейера) у человека наиболее близко с таковому у карликовых свиней. Также у свиней есть миндалины в отличие от мелких грызунов [54, 59]. Свиньи могут осуществлять как носовое, так и ротовое дыхание, а мыши, крысы, морские свинки и кролики нет [60].
Правое легкое свиньи разделено на 4 доли (краниальная, медиальная, каудальная и добавочная), а левое – на 2 (краниальная и каудальная) (рис. 13, 14). Краниальнее бифуркации отделяется трахейный бронх для правой краниальной доли легкого. Дыхательное дерево легких свиньи имеет моноподиальный характер ветвления в отличие от человека [2, 61, 62]. Легкие свиней окружены толстой плеврой с хорошо развитой междольчатой соединительной тканью. Терминальные бронхиолы у свиней относительно длинные и делятся на 2 или 3 короткие бронхиолы, за которыми следуют альвеолы [63].
Микроструктура эпителия легких у свиней похожа на таковую человека. Верхние дыхательные пути выстланы многорядным мерцательным эпителием. Эпителий трахеи представлен реснитчатыми, базальными и секреторными клетками с распределенными между ними бокаловидными клетками. Как и у людей, у свиней наблюдаются хорошо развитые подслизистые железы, что является важным критерием при моделировании муковисцидоза и воспалительных процессов в легких. По направлению к дистальным участкам бронхиального дерева многорядный мерцательный эпителий замещается на нереснитчатый призматический. Большая часть дыхательных путей (от носовой полости до начала дыхательных бронхиол) покрыта слизью, продуцируемой бокаловидными и секреторными клетками. Начиная с терминальных бронхиол к альвеолярной части бокаловидные клетки замещаются на клетки Клара [2, 62, 64].
Наиболее широко карликовые свиньи используются в качестве тест-системы при моделировании кистозного фиброза, который подобен проявлениям муковисцидоза у людей [65–68].
Собаки
Особенности дыхательных путей у собак
Анатомическое строение легких у собаки схоже с таковым у кроликов. Правое легкое состоит из краниальной, медиальной, каудальной и добавочной долей, а левое – из краниальной и каудальной (рис. 15) [2, 69, 70].
Собаки, как и люди, могут осуществлять дыхание через носовую и ротовую полости [71]. Легкие собак окружены тонкой плеврой, имеющей множество лимфатических сосудов [2]. Трахея собак раздваивается на 2 бронха, которые далее моноподиально разветвляются на более мелкие бронхиолы [2, 70]. После нескольких бифуркаций бронхиолы переходят в дыхательные бронхиолы, а затем в альвеолярные мешочки.
Эпителий, выстилающий поверхность трахеи и бронхов, у собак больше похож на человеческий, нежели у кроликов и грызунов (рис. 16). У собак хорошо развиты секреторные клетки и железы. Терминальные и дыхательные бронхиолы состоят из клеток Клара и небольшого количества реснитчатых клеток ( 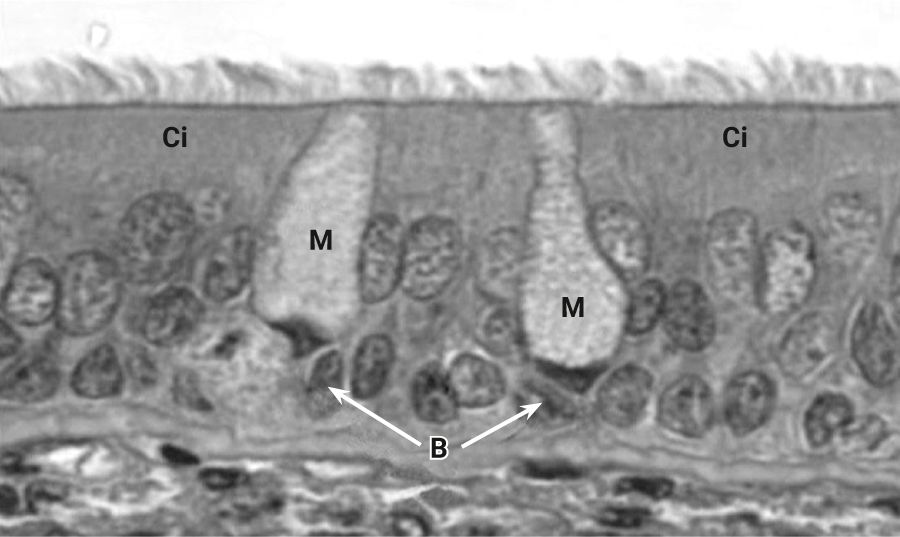
При моделировании патологии легких при вдыхании дыма в течение месяца у собак наблюдаются пролиферация бокаловидных клеток в нижних дыхательных путях, воспалительная инфильтрация, гиперсекреция слизи и повышенное отложение коллагена в паренхиме легких, что характерно для хронического бронхита у человека. Также еще одним преимуществом собак является наличие кашлевого рефлекса, который является одним из основных клинических признаков ХОБЛ. Помимо этого, при более длительном вдыхании сигаретного дыма (годы) у собак происходят патологические изменения, напоминающие эмфизему человека [2, 74, 75].
Заключение
Таким образом, требуется очень тщательный подход к подбору тест-систем при моделировании заболеваний дыхательной системы. Это необходимо для получения более схожих клинических симптомов и патофизиологических процессов при тех или иных патологиях легких, которые наблюдаются у человека, что в дальнейшем позволит лучше прогнозировать фармакодинамические и токсические эффекты лекарственных препаратов в клинической практике. В табл. 2 и 3 обобщены основные отличительные особенности дыхательной системы, преимущества и недостатки различных тест-систем при моделировании патологий легких.
Вклад авторов
Д.Р. Каргопольцева – идея исследования, поиск литературы, написание текста статьи;
А.Е. Кательникова – поиск литературы, редактирование текста статьи
К.Л. Крышень – поиск литературы, редактирование текста статьи
Я.А. Гущин – поиск литературы, редактирование текста статьи
Источник
