Альтернатива выбраковке при разведении декоративных крыс

Начиная разведение крыс самое главное выбрать несколько окрасов и расцветок и сконцентрировать свои усилия на их совершенствовании. Окрасов не должно быть слишком много, иначе у вас на руках окажется куча животных, которым будет трудно подобрать хороших хозяев. Скрещивайте животных разных окрасов, чтобы в помете были представители и того, и другого цвета. Например, при скрещивании голубых агути с голубыми появляются малыши и той, и другой окраски, а иногда и альбиносы. При скрещивании черной самки с самцом голубого окраса в потомстве могут быть черные, голубые, норковые и белые малыши. Причем многие из них выставочного качества.
Техника разведения. Многие заводчики держат животных вместе пока не удостоверятся, что самка беременна. А затем они забывают вовремя удалить самца и бац! — нежелательное потомство. Чтобы этого не случилось, вязку надо планировать. Следите за самкой и как только увидите, что у нее течка, подсаживайте к ней самца, но не больше чем на одну ночь. Самца нельзя надолго убирать от его сотоварищей, так как они могут потом не принять его обратно. Когда самец сделает свое дело, верните его в его клетку, а самку — в ее, где она и может оставаться почти до самых родов. Старайтесь, чтобы одновременно у вас появлялось не более двух пометов и планируйте рождение малышей таким образом, чтобы они могли участвовать в шоу. Выставка — это самое удачное место, где можно найти любящих хозяев для малышей. Но все же не мешает убедиться, что они получат ту любовь, которую заслуживают и не пойдут на корм змеям.
Реализация через зоомагазины. Если у вас есть симпатичные крысы с родословной, то некоторые зоомагазины согласятся приобрести их по более высокой цене, чем та, которую обычно платят за крыс, идущих на корм рептилиям. Так что в ваших интересах продать их за цену, которая гарантирует, что ваши питомцы не погибнут в желудках рептилий. К сожалению, эти же самые магазины также принимают крыс у профессиональных поставщиков корма для змей. Как правило, эти люди не заботятся о здоровье своих животных, и многие породистые крысы могут заразиться различными болезнями и принести их в тот дом, куда они попадут.
Последнее средство. Чтобы вам не приходилось делать выбраковку, ограничьте количество животных, содержащихся у вас, а также держите у себя малышей пока не подыщите им хороший дом. Если это невозможно, то как последнее средство используйте гуманные методы эвтаназии.
У вас должны быть связи с хорошим ветеринаром, который, будучи в курсе ваших проблем, может помочь вам в этом вопросе.
Он может оказать содействие в приобретении хлороформа, или более качественного препарата, например Галотана. Более гуманно усыплять животное при помощи вещества, которое нужно вдыхать, а не инъекции.
Если ветеринар отказывается сотрудничать с вами, то следующий способ эвтаназии заключается в использовании сухого льда. Следите только, чтобы животное его не касалось. Этот метод часто используют те, кто умерщвляет крыс на корм змеям. Но для вас самым лучшим было бы найти ветеринара, который согласится вам помогать.
Негуманные методы.
Цервикальная дислокация. Не пытайтесь проделать это сами. Для крыс этот метод не подходит.
Смывание в унитаз. Какая ужасная смерть! Представьте себя на месте животного, понравилось бы вам быть утопленным?
Замораживание. Гипотермия это длительный и далеко не безболезненный процесс. Есть впечатления людей, которые на себе опробовали, что это такое. Кажется, что животное мирно умирает, но шаги, приводящие к такой смерти, являются страшно болезненными. Вспомните, что в мороз происходит с вашими голыми руками, прежде чем они потеряют чувствительность. Представьте себе, что бы вы чувствовали, если бы кто-то, кого вы любили, посадил вас в гигантский морозильник, выключил свет, запер дверь и ушел. Вообразите весь свой ужас! Какой жуткий способ умереть!
Отпускание на волю. Речь здесь идет о домашних животных. У них нет опыта выживания в естественной среде. Во-первых, животное, выросшее в клетке и оказавшееся в открытом пространстве, испытывает страх, что негуманно по отношению к нему. Во-вторых, оно может попасть на обед кошке, хищной птице или другим животным. Это тоже не слишком приятно.
Продажа крыс в качестве пищи для рептилий. Если вы выпустите крысу на улицу, у нее есть шанс избежать этой ужасной участи. Но если дать крысу на съедение змее, то ее ожидает не только смерть, но и мучительное ее ожидание, так как рептилия иногда не трогает свою потенциальную жертву в течение нескольких дней. Если мышка или крыса были выращены человеком и привыкли ему доверять, то действительно ужасно, когда человек отдает это маленькое доверчивое существо на съедение рептилии. Многие люди не верят, что животные имеют интеллект, но они могут и любить, и доверять, и бояться.И в заключение хочется сказать, что владельцам декоративных крыс и мышей следует брать пример с заводчиков собак и кошек, которые разводят животных, чтобы улучшить характеристики породы, но не допускают бесконтрольного размножения. А также, чтобы не чувствовать себя убийцами, надо больше времени тратить на то, чтобы познакомить людей с такими замечательными домашними животными как крысы и мыши, надо искать хорошие дома для них, где они получат ту заботу и любовь, которой заслуживают.
Правообладатель: портал Зооклуб
При перепечатке данной статьи активная ссылка на источник ОБЯЗАТЕЛЬНА, в противном случае, использование статьи будет рассматриваться как нарушение «Закона об авторских и смежных правах».
Источник
Цервикальная дислокация у крыс
Сообщение Anton » 19 сен 2010, 05:34
Эвтаназия (eu — хорошее и thanatos – смерть, греч.) — гуманное умерщвление животного.
Методы эвтаназии должны приводить к быстрой потере сознания, сопровождающейся остановкой сердца и дыхания, окончательной потерей функции мозга, а также быть надежными и необратимыми. Кроме того, используемая техника должна минимизировать боль и эмоциональный стресс, испытываемые животным до момента потери сознания. Выбор соответствующего метода эвтаназии в любой ситуации зависит от вида животного, навыка персонала, числа животных, и др.
Ударник (пробойник) используется для эвтаназии жвачных, лошадей, свиней, лабораторных кроликов, собак. Способ действия заключается в сотрясении и травме головного мозга. Энергию ударник получает от взрыва пороха или от сжатого воздуха, и она должна быть достаточной, чтобы обеспечить проникновение через череп животного. Чтобы вызвать внезапную потерю сознания и последующую смерть должны быть достаточно разрушены полушария головного мозга и его ствол. Для крупного рогатого скота используют многократное применение.
Если ударник не проникает сквозь черепную коробку, то он только оглушает животных и, в таком случае, этот метод не должен использоваться как единственное средство эвтаназии.
Преимущество. Эффективный метод эвтаназии для использования на скотобойнях, фермах, когда применение наркотических препаратов нежелательно.
Недостатки. Может вызвать эстетическое недовольство. Смерть может не наступать при плохом качестве оборудования, или если оно не используется должным образом.
Эвтаназия ударом по голове. Может быть гуманным методом эвтаназии животных с тонким черепом, если одного удара по центральным костям черепа достаточно для депрессии центральной нервной системы и разрушения тканей мозга. При правильном выполнении потеря сознания наступает быстро. Персонал, выполняющий эвтаназию таким методом должен быть обучен.
Цервикальная дислокация – метод используется давно, и если он выполняется подготовленным персоналом, считается гуманным. Этот метод применяется для эвтаназии домашней птицы, другой мелкой птицы, мышей, молодых крыс и кроликов. При эвтаназии мышей и крыс, большой и указательный пальцы помещаются с обеих сторон шеи у основания черепа или накладывают металлический прут у основания черепа.
Другой рукой делают рывок за основание хвоста или задних конечностей, производя отрыв позвоночника от черепа. При эвтаназии крольчат, голову держат в одной руке, задние конечности в другой. Для домашней птицы этот метод эвтаназии – обычный массовый метод, но он не гарантирует мгновенную потерю сознания.
Существуют данные, указывающие, что электрическая деятельность мозга сохраняется еще в течение 13 секунд после цервикальной дислокации.
Преимущества. Методика, при которой достигается достаточно быстрая потеря сознания. Ткани организма химически не загрязняются.
Недостатки. Может вызывать эстетическое недовольство у персонала. Требует технических навыков для гарантии быстрой потери сознания. Использование ограничено домашней и мелкой птицей, молодыми крысами, мышами и кроликами.
Сдавливание грудной клетки. Используется при эвтаназии мелких и среднего размера птиц, в случае, когда другие описанные методы не подходят.
Преимущества. Метод быстр, очевидно безболезнен. Позволяет использовать тело птицы для различных исследований.
Недостатки . Эстетически неприятен для наблюдателя. Неизвестна степень страданий. Следует использовать в случае невозможности применения других методов эвтаназии.
Метод эвтаназии: большой и указательный пальцы одной руки располагают под крылом птицы на ребрах, указательный палец другой руки помещают против брюшного края грудины, сильно сдавливают и удерживают до остановки сердечной деятельности и дыхания. Потеря сознания и гибель наступают быстро. Метод не подходит для эвтаназии крупных или ныряющих птиц и для животных других видов.
(Методические указания по биоэтическим правилам проведения экспериментальных исследований (выдержки))
Источник
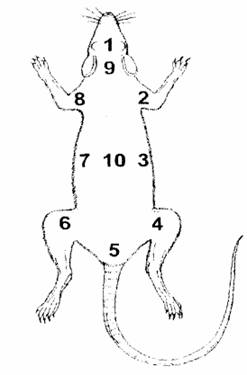
Курс экспериментальной физиологии
 |  | |
 | Бионауки: методы Выделение ДНК из клеток (фенольный метод) Выделение ДНК из культуры клеток (высокосолевой метод) Выделение ДНК с использованием протеиназы К Гель-электрофорез ДНК Лабораторные животные в бактериологии Люминисцентная микроскопия: метод флуорохромирования Методика изолированного сердца теплокровного животно Изучение общетоксического действия фарм средств Доклиническое изучение репродуктивной токсичности Курс экспериментальной физиологии Методические указания по диагностике бешенства Исследования на пироплазмидозы животных Диагностика токсоплазмоза животных Изучение нейролептической активности лексредств Исследование мутагенности новых фарм средств Техника вскрытия лабораторных животных |  |
 |  |
 |  |
 | |