Влияние различных видов анестезии на параметры электрокардиограммы у крыс
Н.А. Лычева(1), канд. биол.наук, с.н.с., руководитель группы токсикологии, М.Н. Макарова(2), директор, В.Г. Макаров(1), доктор медицинских наук, профессор, зам. директора по науке, А.В. Рыбакова(2), канд. вет. наук, зам. директора по ветеринарии 1-Санкт-Петербургский институт фармации, 188663, Россия, Ленинградская обл., Всеволожский район, г.п. Кузьмоловский, ул. Заводская, дом 3, корп. 245; 2-НПО «Дом Фармации» 188663, Россия, Ленинградская обл., Всеволожский район, г.п. Кузьмоловский, ул. Заводская, дом 3, корп. 245 Е-mail: Natalia.lycheva@yandex.ru
Резюме
Электрокардиография (ЭКГ) – один из самых распространенных диагностических методов в медицине. Запись ЭКГ отражает электрическую активность сердца и позволяет получить важную информацию о функциональных и структурных характеристиках миокарда. ЭКГ у крыс используется в исследованиях состояния сердечно-сосудистой системы как в физиологических условиях, так и при моделировании различных патологических процессов. Техника записи ЭКГ проста, однако интерпретация параметров ЭКГ является сложной задачей. Это связано с относительно небольшим количеством экспериментальных исследований, а также значительной вариацией параметров ЭКГ между исследованиями. Необходимость подобных исследований обусловлена не только все большим ростом интереса к данным ЭКГ в экспериментальной физиологии, патофизиологии, доклинических исследованиях, но и быстрым развитием трансляционных исследований. Рассмотрены параметры ЭКГ у крыс, их нормальный диапазон, а также влияние типа анестезии на изменение параметров ЭКГ. Обзор ограничивается аутбредными крысами (крысы с непрослеживаемой родословной) и крысами линий Sprague Dawley и Wistar, так как эти животные чаще всего служат экспериментальными моделями для научных исследований. Исследование выполнено на 250 аутбредных крысах обоего пола. ЭКГ записывали на фоне наркотизации смесью тилетамина и золозепама. Проведенный анализ литературы демонстрирует отсутствие конкретных рекомендации по оценке ЭКГ у крыс и интерпретации полученных данных. Установлено отсутствие половых различий в параметрах ЭКГ у крыс. Определено влияние указанной анестетической смеси на вариабельность частоты сердечных сокращений. Длительность интервала PQ была сопоставима со значениями, полученными на фоне уретанового наркоза. В то же время отмечено значительное увеличение комплекса QRS. Также обращает на себя внимание увеличение значения интервала QTс, показанное нами впервые при использовании указанной смеси анестетиков.
Введение
Анализ электрокардиограммы (ЭКГ) у крыс используется в исследованиях состояния сердечно-сосудистой системы, в том числе при оценке кардиотоксичности, не только в физиологических условиях, но и при введении различных лекарственных средств, а также при моделировании различных заболеваний у животных. Техника записи ЭКГ проста, однако интерпретация параметров ЭКГ является сложной задачей. Как показал анализ литературных данных, существует множество дискуссионных аспектов в изучении ЭКГ крыс, так, например, нет информации о нормальной продолжительности зубца Р на ЭКГ. Спорным остается вопрос о частоте сердечных сокращений (ЧСС) [18, 19, 22] и критериях контрольных значений ЭКГ у крыс. Кроме того, отмечаются значительные межгрупповые различия в параметрах ЭКГ, что, по-видимому, обусловлено условиями эксперимента, возрастом, линией животных, типом используемой анестезии [16, 18, 19]. На базе АО «Дом Фармации» проведено сравнительное исследование по изучению параметров ЭКГ у аутбредных крыс. Нами рассмотрены параметры ЭКГ у крыс, их нормальный диапазон, а также влияние анестезии на изменение параметров ЭКГ. Обзор ограничивается аутбредными крысами, крысами линий Sprague Dawley и Wistar, так как эти животные чаще всего используются в доклинических исследованиях.
Материал и методы
В исследовании использовались 250 аутбредных крыс собственного разведения с подтвержденным статусом здоровья. Животные содержались в стандартных условиях вивария. Исследование выполнено в соответствии с принципами GLP и Европейской конвенцией по защите позвоночных животных (одобрено на заседании биоэтического комитета, заключения №БЭК 3.27/17).
В исследовании использовались самцы (n=125) и самки (n=125) аутбредных крыс, наркотизированные смесью тилетамина, золозепама и клисазина. Животных наркотизировали путем внутримышечного введения ксилазина в дозе 10–15 мг/кг для общего анальгетического эффекта, через 15 мин вводили смесь тилетамина и золозепама в дозе 50–80 мг/кг для развития общей анестезии. Запись параметров ЭКГ у животных проводили на ветеринарном электрокардиографе «Поли-Спектр 8В» в течение 10±3 мин.
Животное укладывали на столик и закрепляли на конечностях электроды (верхние конечности – на предплечьях, нижние конечности – на внутренней стороне бедра) согласно инструкции к прибору; при этом место крепления электродов смачивали солевым раствором.
По окончании исследования животные подвергались клиническому осмотру и возвращались в стоковую популяцию.
Результаты и обсуждение
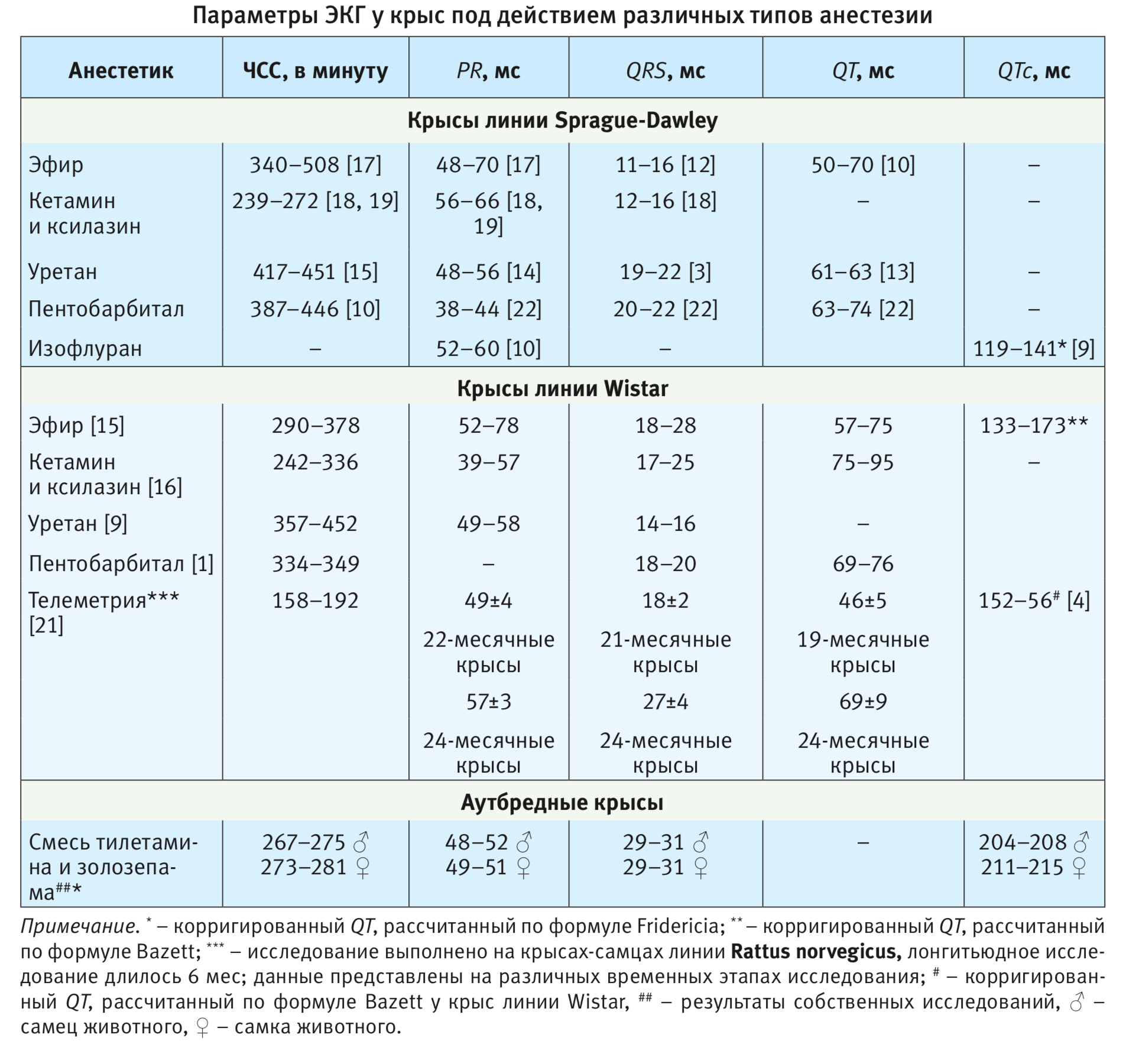
В ходе исследования установлено, что параметры ЭКГ не зависели от пола животного (см. таблицу). Использование указанной анестетической смеси снижает вариабельность ЧСС по сравнению с данными телеметрии и другими средствами для наркоза. Длительность интервала PQ (PR) укладывается в описанные диапазоны значений и наиболее сопоставима со значениями, полученными на фоне уретанового наркоза [9, 14]. В то же время отмечено значительное увеличение комплекса QRS на фоне анестезии смесью тилетамина и золозепама. Также обращает на себя внимание увеличение значения интервала QTс, показанное нами впервые при введении указанной смеси анестетиков. Согласно анализу литературы, выявлено выраженное влияние анестезии на длительность интервалов и зубцов на ЭКГ. Данные литературы систематизированы (см. таблицу). Установлено, что ингаляционные анестетики могут иметь аритмогенный потенциал. Галотан, изофлуран и энфлуран блокируют Ca 2+ -каналы и обмен Na + / Ca 2+ в кардиомиоцитах [15]. Крысы, анестезированные уретаном, демонстрируют значительное увеличение ЧСС, в отличие от крыс, получавших пентобарбитал и тиопентал.
Было обнаружено, что пентобарбитал вызывает желудочковые аритмии [24]. Также установлено, что тиопентал обладает антиаритмической активностью [24]. Другой широко используемый анестетик кетамин, помимо его анти-NMDA-активности, взаимодействует с потенциал-зависимыми Са 2+ -каналами в кардиомиоцитах, существенно изменяя их электрическую активность [3]. В литературе не найдено данных об особенностях влияния эфира (он не рекомендован для анестезии).
Патофизиологические изменения, связанные с токсическим воздействием или болезнью, у грызунов и людей проявляются на ЭКГ аналогично.
Млекопитающие имеют широкий диапазон интервала RR в покое. Для взрослого человека период покоя RR колеблется от 0,6–1,0 с (ЧСС≈60–100 в минуту), тогда как для зрелых крыс RR-интервал составляет 0,118–0,251 с (ЧСС≈239–508) в зависимости от типа использованного анестетика [9]. Изменения ЭКГ (включая увеличение зубца P, увеличение интервала PR, удлинение или отклонение оси комплекса QRS, и изменения зубца T) с сопутствующей оценкой гистопатологии, имеют высокую прогностическую ценность для многих форм заболеваний сердца у крысы [4].
Зубец P. При записи ЭКГ зубец P отражает деполяризацию предсердий. Как у человека, так и у крыс физиологический синусовый ритм характеризуется положительным зубцом Р во II отведении, отрицательным зубцом Р в отведении aVR и наличием комплекса QRS после каждого зубца Р. Отсутствие зубца Р или его измененная форма регистрируется при аритмиях различного генеза, наиболее распространенными из которых являются фибрилляция предсердий. Как и у людей, фибрилляция предсердий у крыс характеризуется отсутствием зубца Р [17].
Интервал PQ (PR). Ввиду отсутствия зубца Q интервал PQ также называется интервалом PR и отражает распространение деполяризации от предсердий к желудочкам [18]. Анализ длины интервала PR имеет решающее значение для диагностики атриовентрикулярных блокад. Длительные интервалы PR могут свидетельствовать об атриовентрикулярной блокаде или нарушении проводимости сердца [4]. Интервал PR у крыс SD колеблется от 38 до 70 мс, у крыс Wistar – от 39 до 78 мс, продолжительность интервала варьирует в зависимости от типа анестезии.
Комплекс QRS. Продолжительность комплекса QRS показывает время деполяризации желудочков. Сужение комплекса QRS наблюдается в суправентрикулярных аритмиях, тогда как увеличение комплекса QRS отмечается при желудочковом ритме, а также нарушениях внутрижелудочковой проводимости, которые бывают при блокадах ветвей пучка Гиса, сердечной недостаточности и ишемии миокарда. Изменения комплекса QRS (удлинение или фракционирование) также наблюдаются у лиц с повышенным риском аритмии, а при раздвоении свидетельствуют о частичной блокировке проведения возбуждения [4]. Широкие QRS-комплексы были обнаружены после лечения крыс несколькими препаратами, например доксорубицином [12], дизопирамидом [13] и азитромицином [2]. Кроме того, патологический зубец Q (отличительная черта некроза миокарда при инфаркте миокарда человека), был продемонстрирован в нескольких моделях инфаркта миокарда и кардиомиопатиях на крысах [5]. Поскольку Q-волна обычно не обнаруживается у крыс, то на ЭКГ крысы оцениваются комплексы RS.
Сегмент ST. Сегмент ST представляет собой время деполяризации желудочков и определяется как время от конца комплекса QRS до начала волны T. Сегмент ST является изоэлектрическим и у людей длится от 80 до 120 мс. Оценка параметра имеет значение для диагностики ишемии и инфаркта миокарда. Для людей критерии существенных изменений сегмента ST подробно описаны [24]. Изменение сегмента ST также наблюдается при каналопатиях, например, при синдроме Бругада, внутрижелудочковых блокадах, нарушениях водно-электролитного баланса и других патологиях. Исследования на крысах показали значительные изменения сегмента ST при инфаркте миокарда [6] и ишемии миокарда [22]. Однако четкие критерии значительных изменений сегмента ST не установлены. Сообщалось, что у крыс линии SD, находящихся под легкой эфирной анестезией, продолжительность сегмента ST составляла 12,3–18,1 мс [12], тогда как у крыс Wistar, анестезированных эфиром, – 9,58–14,8 мс [8]. Однако значение длины сегмента ST для анализа ЭКГ не так важно. Во-первых, трудно обнаружить сегмент ST на ЭКГ крыс [11]. Во-вторых, на фоне увеличения сегмента ST всегда увеличивается интервал QT (RT). Поэтому удобнее анализировать 2 последних параметра, а не сегмент ST. Депрессия сегмента ST характерна для ишемии и гипоксии миокарда желудочков [9].
Зубец T. Зубец T отражает процесс реполяризации желудочков, является положительным в большинстве отведений, включая II отведение. У людей высокую амплитуду зубца Т можно обнаружить при гиперкалиемии, на ранних стадиях острого инфаркта миокарда и у пациентов с синдромом удлиненного QT. Уменьшение амплитуды зубца Т может наблюдаться при гипокалиемии, тогда как отрицательный зубец Т может свидетельствовать о инфаркте миокарда и тромбоэмболии легочной артерии. Сообщалось об инверсии зубца Т на ЭКГ крысы после инъекции изопротеренола и при инфаркте миокарда [11]. Гипокалиемия у крыс сопровождается удлинением и уменьшением амплитуды зубца T [1].
Интервал QT. У крыс этот параметр обычно измеряется от начала комплекса RS до конца зубца T из-за трудностей в обнаружении зубца Q. Интервал QT представляет собой время деполяризации и реполяризации кардиомиоцитов желудочков. Патологическая продолжительность этого параметра указывает на нарушения электрической активности сердца из-за кардиомиопатий различного происхождения или токсического воздействия экзогенных соединений. Так, интервал QT может быть удлинен при гипокалиемии, ишемии, инфаркте миокарда, каналопатии (синдром удлиненного QT). Наконец, несколько препаратов могут удлинять интервал QT приводя к желудочковой тахиаритмии, включая пируэтную тахиаритмию (torsades de pointes). Таким образом, удлинение интервала QT считается показателем кардиотоксичности лекарственного средства [20]. Интервал QT положительно коррелирует с массой левого желудочка у гипертензивных крыс, отражая фенотипические изменения сердца, связанные с механическим напряжением [3]. Показано, что у крыс, подвергавшихся воздействию различных концентраций известного кардиотоксического вещества доксорубицина учащается пульс, возникают аритмии и аномалии ЭКГ, включая удлинение QT и желудочковую тахикардию, с последующим развитием фибрилляции желудочков, что сопровождается развитием гемодинамических нарушений, формированием асцита, снижением температуры тела, снижением массы тела и, в конечном счете, смертью [11]. Интервал QT, когда он рассчитан с учетом ЧСС (скорректированный QT – QTc), позволяет оценивать аномалии в реполяризации желудочков, так как Q-волна зачастую отсутствует на ЭКГ крыс; зубец R используется как аналог для Q. Пространственно-временная неоднородность реполяризации применялась для выявления пациентов с риском сердечной смерти [13].
Заключение
Проведенный анализ литературы демонстрирует отсутствие конкретных рекомендации по оценке ЭКГ у крыс. Обращают на себя внимание существенные различия при оценке нормального диапазона значений ЭКГ крыс у разных исследователей. Изучение параметров ЭКГ у крыс остается актуальной и первостепенной задачей для исследователей различного уровня. Необходимость подобных исследований обусловлена ростом интереса к данным ЭКГ в экспериментальной физиологии, патофизиологии, доклинических исследованиях, в частности при оценке фармакологической безопасности. Ввиду сложности интерпретации параметров ЭКГ у экспериментальных животных проблематична и экстраполяция полученных результатов на человека. Это связано с относительно небольшим количеством экспериментальных исследований, а также значительной вариацией параметров ЭКГ у разных авторов, которые вероятно, использовали разные линии крыс и средства для наркоза.
Источник
Способ проведения наркоза у крыс при многоэтапном эксперименте при моделировании эндометриоза
Владельцы патента RU 2466753:
Изобретение относится к экспериментальной медицине и может быть использовано при проведении многоэтапного эксперимента по моделированию эндометриоза. Для этого осуществляют премедикацию ксилазином. Для проведения основного наркоза внутримышечно вводят препарат «Zoletil 50» в дозе 0,5 мг/кг массы тела крысы. Способ обеспечивает адекватную анестезию при одновременном сокращении времени выхода крысы из наркоза, что снижает вероятность развития послеоперационных осложнений. 1 пр.
Изобретение относится к области медицины и может быть использовано при проведении экспериментальных исследований для введения в наркоз.
Известны способы введения в наркоз экспериментальных животных с помощью наркотических анальгетиков (морфин, промедол), нейролептиков (дроперидол), антигистаминных веществ (димедрол, супрастин), холинолитиков (атропин), применяемых в дозах: морфин 0,5 мл/кг массы тела 1% раствора; дроперидол — 0,5 мг/кг массы тела 0,25% раствора; димедрол 1,5 мг/кг массы тела 1% раствора; атропин 0,0001 /10 кг/ массы тела 0,1% раствора (Шалимов С.А., Радзиховский А.П., Кейсевич Л.В. Руководство по экспериментальной хирургии, — М.: Медицина, 1989, с.153-156. С.А.Шалимов, В.П.Радзиховский, Л.В.Кейсевич «Руководство по экспериментальной хирургии». М.: Медицина, 1989 г. Р.С.Сатоскар, С.Д.Бандаркар, «Фармакология и фармакотерапия», М.: Медицина, 1986, И.С.Чекман, А.П.Пелещук, О.А.Пятак «Справочник по клинической фармакологии и фармакотерапии. «Киев, «Здоров’я» 1986 г.).
Однако применяемые для введения в наркоз лекарственные препараты и их сочетания обладают рядом недостатков, а именно: угнетают дыхание и иногда вызывают его остановку до развития хирургического наркоза; вызывают угнетение сосудодвигательного центра и замедляют выход из наркоза, т.к. их клинические эффекты продолжаются в течение 3-6 часов; усиливают рвотный рефлекс и обладают антидиуретическими свойствами; являются строго учетными препаратами, что ограничивает их применение; несовместимы с барбитуратами из-за резкого нарушения дыхания; способствуют у собак дегидратации, развитию метаболического ацидоза, нестабильности гемодинамики с наклонностью к гипотонии (С.А.Шалимов, А.П.Радзиховский, Л.В.Кейсевич «Руководство по экспериментальной хирургии». — М.: Медицина, 1989 г.).
В физиологическом эксперименте на животных широко применяется более длительный внутривенный наркоз (хлоралоза, нумал, диал). Эти вещества, имеющие различный химический состав, действуют в течение нескольких часов и позволяют производить длительные операции и многочасовые исследования на живом организме. Особенно широко применяется в опытах на животных хлоралоза (или хлоралозан) (Кассиль Г.Н. Наука о боли. — М.: Медицина, 1975). Недостатками такого наркоза являются трудность попадания в вену экспериментальных животных с весом (например, крысам с живым весом 150-200 г), длительный выход из наркоза, повышающий вероятность тяжелых осложнений, приводящих к летальному исходу и т.д.
Известен способ проведения наркоза в эксперименте на животных, заключающийся в проведении премедикации, вводного и основного наркоза, при этом экспериментальному животному последовательно, с интервалом 3-4 минуты, внутримышечно вводят лекарственную смесь следующего состава: дроперидол, димедрол, атропин, кеталар в терапевтических дозах; затем внутримышечно реланиум в дозе 0,002-0,005 мг/кг массы тела, 100 мг Трамала, после чего внутриплеврально последовательно, с интервалом 3-4 минуты вводят кеталар в дозе 1-2 мг/кг массы тела и 5% раствор Тиопентал-Na в дозе 3-5 мг/кг массы тела (Пат. №2072872 РФ. МПК 6 A61M 21/00. (Способ проведения неингаляционного наркоза в эксперименте на животных. / Дмитриев О.В. Опубл. 10.02.1997 г.). Недостатки данного способа: необходимость применения большого числа препаратов, отрицательное воздействие барбитуратов на организм. Тиопентал натрия — препарат барбитурового ряда — обладает высокой токсичностью и оказывают прямое депрессорное влияние на дыхательный центр и сердечно-сосудистую систему. Степень этих изменений возрастает по мере углубления наркоза (Бунятян А.А. Справочник по анестезиологии и реаниматологии, М., 1982, с.150).
Известно применение препарата «Zoletil 50» для проведения общей анестезии с премедикацией препаратами-ваголитиками (атропин), это связано с необходимостью блокировать влияние блуждающего нерва на сердечно-сосудистую систему, иначе при операциях (особенно полостных) есть риск перераздражения вагуса, что может привести к остановке сердца. При использовании препарата «Zoletil 50» также рекомендуется использовать атропин в дозе 0,04 мг/кг. Недостатки данного способа: при передозировке атропина могут наблюдаться различные неврологические и соматические расстройства. При внутривенном введении атропина может возникнуть фибрилляция желудочков сердца. (Инструкция к препарату «Zoletil 50»). Известно также применение препарата «Zoletil 50» с премедикацией ксилазином. Ксилазин (препарат Ксила в 1 мл раствора содержит ксилазина гидрохлорида 20 мг) обладает потенциальным анальгетическим эффектом, за которым следует доминантный седативный эффект. В зависимости от дозы он вызывает угнетение ЦНС, снижает двигательную активность и часто, в первые несколько минут, наблюдается атаксия. Препарат обладает успокаивающим, болеутоляющим, анестезирующим и миорелаксационным действием. В качестве премедикации перед наркозом ксилазин снимает мышечное напряжение, а за счет седативного действия смягчает выход из наркоза.
«Zoletil 50» — препарат для общей анестезии, содержащий в качестве действующих веществ тилетамина гидрохлорид и золазепама гидрохлорид (125 мг тилетамина гидрохлорида и 125 мг золазепама гидрохлорида). Тилетамин — общий анестетик диссоциативного действия, вызывающий выраженный анальгетический эффект, но недостаточное расслабление мышц. Тилетамин не подавляет глоточный, гортанный, кашлевой рефлексы, не угнетает дыхательную систему. Золазепам угнетает подкорковые области мозга, вызывая анксиолитическое и седативное действия, расслабляет поперечно-полосатую мускулатуру. Золазепам усиливает анестетическое действие тилетамина. Он также предотвращает судороги, вызванные тилетамином, улучшает мышечную релаксацию и ускоряет восстановление после наркоза. «Zoletil 50» — это последнее поколение диссоциативов, он разрешен к применению на территории Российской Федерации и не внесен в список сильнодействующих и психотропных препаратов ввиду отсутствия психотропного эффекта, что позволяет применять препарат «Zoletil 50» в ветеринарии абсолютно легально. «Zoletil 50» не снижает температуру тела, не вызывает кардиореспираторной депрессии и не оказывает токсического влияния на печень и почки, сохраняя при этом ларингеальный, фарингеальный и пальпебральный (моргательный) рефлексы, может использоваться у беременных и новорожденных животных. «Zoletil 50» можно комбинировать с ксилазином. В связи с тем что «Zoletil 50» обладает выраженным анальгетическим эффектом при применении субнаркотических доз, ксилазин необходим как миорелаксант, чтобы достичь достаточной глубины наркоза. Комбинация ксилазин — «Zoletil 50» является синергичной. При комбинированном наркозе с использованием «Zoletil 50» и ксилазина рекомедуются следующие дозировки для собак и кошек: ксилазин 0,05 мл/кг при в/м и в/в применении однократно «Zoletil 50» 1-2 мг/кг (Инструкция к препарату «Zoletil 50»). Дозировки для животных с низкой массой тела не указаны. Этот способ выбран за прототип. Недостатками его являются недостаточно быстрый выход из наркоза (3-4 часа) лабораторных животных — крыс-самок, увеличивается риск осложнений в послеоперационном периоде по типу пневмоний, что может закончиться летальным исходом и потерей лабораторного животного для дальнейшего проведения эксперимента при моделировании эндометриоза.
Задачей изобретения является повышение выживаемости лабораторных животных — крыс в условиях длительного многоэтапного эксперимента при моделировании эндометриоза.
Технический результат заключается в сокращении времени выхода из наркоза лабораторного животного — крысы, что снижает вероятность развития послеоперационных осложнений при моделировании эндометриоза.
Это достигается за счет того, что препарат «Zoletil 50» вводят в дозе 0,5 мг/кг массы тела крысы.
На кафедре репродуктивной медицины и хирургии ФПДО ГОУВПО «Московского государственного медико-стоматологического университета Минздравсоцразвития РФ» проводились исследования по созданию модели экспериментального эндометриоза. Заболевание моделировали аутотрансплантацией (эндометрием внутрь перитонеума) одного фрагмента эндометрия с миометрием (3×3 мм), полученного из левого рога матки, к поверхности брюшины передней брюшной стенки. Все эксперименты проводили в соответствии с требованиями Женевской Конвенции «International Guiding Principles for Biomedical Research Involving Animals» (Geneva, 1990).
В ходе эксперимента применялся наркоз по способу-прототипу: для премедикации каждой крысе-самке вводили внутримышечно ксилазин в дозе, рассчитанной по инструкции в соответствии с весом животного, затем через 10 мин вводили «Zoletil 50», также в дозе, рассчитанной по инструкции. Однако за время выхода из наркоза, составляющее 3-4 часа, у крыс-самок в 5-10% случаев развивалась пневмония и животные погибали, что отрицательно сказывалось на получении статистически достоверных данных при мониторинге за очагом эндометриоза. Опытным путем, постепенно снижая дозу вводимого «Zoletil 50» и доведя ее до половинной по сравнению с исходной, равной 1 мг/кг массы тела, при этом длительность наркоза составляла 35-40 мин, что было достаточно для проведения операции по моделированию экспериментального эндометриоза. Был достигнут результат, при котором время выхода из наркоза сократилось вдвое, а выживаемость лабораторных животных — крыс-самок — стала практически 100%-ной на протяжении всего многоэтапного эксперимента при моделировании эндометриоза: после операции животные содержались в виварии в течение 4 недель для приживления имплантов, после чего производили измерение размеров и морфологическую оценку полученных имплантов, кроме того, животному выполнялось не одно, а два или три чревосечения, что важно для мониторинга за очагом эндометриоза под воздействием различных апробируемых лечебных факторов в эксперименте.
Способ осуществляется следующим образом:
за 15 мин до основного наркоза с целью премедикации крысе внутримышечно вводят ксилазин (препарат Ксила) в дозе 0,05 мл/кг массы тела (по инструкции), затем через 10 мин вводят «Zoletil 50» в дозе 0,5 мг/кг массы тела.
За 15 минут до основного наркоза крысе-самке линии Вистар (разводки питомника «Столбовая») весом 210 граммов, находящейся в фазе проэструса, внутримышечно ввели ксилазин (препарат Ксила) в дозе 0,01 мл, а через 10 мин после премедикации ввели «Zoletil 50» в дозе 0,105 мг. Длительность наркоза составила 35 минут. Выход животного из наркоза — 98 минут. После операции крыса содержалась в виварии в условиях регулируемого светового дня (12×12 часов) и постоянной комнатной температуры (23±2°C) на стандартном пищевом рационе и свободном доступе к воде в течение 4 недель для приживления имплантов, в ходе дальнейшего эксперимента животному произвели еще 2 чревосечения. После проведенных операций лабораторное животное осталось живо.
Способ проведения наркоза у крыс при многоэтапном эксперименте при моделировании эндометриоза, включающий проведение премедикации ксилазином и основного наркоза препаратом «Zoletil 50» внутримышечно, отличающийся тем, что препарат «Zoletil 50» вводят в дозе 0,5 мг/кг массы тела крысы.
Источник